A cura di Ismael Galve-Roperh

Ismael Galve-Roperh, biochimico e biologo molecolare con oltre 20 anni di esperienza nella ricerca sui cannabinoidi. Ha fornito alcuni importanti contributi alla disciplina, tra i quali, la scoperta del ruolo antitumorale della segnalazione dei cannabinoidi, i suoi effetti neuroprotettivi nelle malattie neurodegenerative e l'impatto di questi composti sullo sviluppo neurologico.
Ismael Galve-Roperh1, Alline Campos2, Francisco Guimaraes2, Manuel Guzmán1
1 Scuola di Biologia e Instituto Universitario Investigación Neuroquímica, Università Complutense, 28040 Madrid (Spagna), Centro Investigación Biomédica Red Enfermedades Neurodegenerativas (CIBERNED) e Instituto Ramón y Cajal de Investigaciones Sanitarias (IRYCIS)
2 Dipartimento di Neurofarmacologia, Università di San Paolo, Riberao preto, Brasile
Recentemente, è stata lanciata la prima rete di ricerca latinoamericana sui cannabinoidi finanziata a livello pubblico (CannaLatan, www.cyted.org/es/cannalatan), formata da accademici e aziende farmaceutiche di diversi paesi. CannaLatan mira a promuovere e potenziare i risultati ottenuti dai diversi partner del consorzio sviluppando progetti di ricerca ed educativi in collaborazione. La rete CannaLatan è dedicata ad affrontare le potenziali applicazioni terapeutiche di fitocannabinoidi poco studiati e di nuove molecole a base di cannabinoidi, così come a chiarire i loro efffetti indesiderati. Qui discutiamo uno dei progetti in corso avviati da CannaLatan con il sostegno finanziario della Fundación Canna (www.fundacion-canna.es/), in cui ci occupiamo degli effetti anti-psicotici e cognitivi delle forme acide dei fitocannabinoidi, ovvero THCa (Figura 1A).
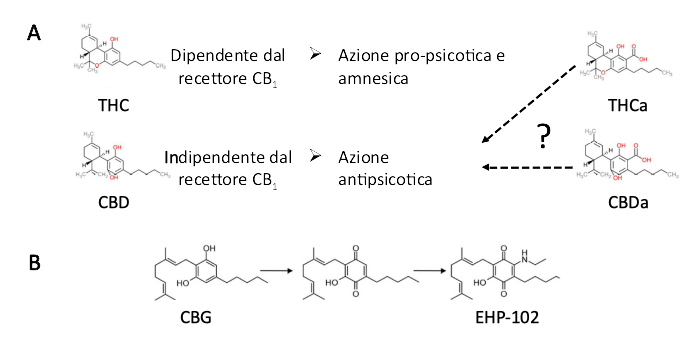
Chiave della figura. A) Azioni differenziate delle forme neutre e acide dei due fitocannabinoidi più studiati: THC e CBD. B) utilizzazione di modelli strutturali di fitocannabinoidi per lo sviluppo di molecole terapeutiche migliorate, come esemplificato dai derivati del chinone CBG.
La pianta Cannabis sativa contiene più di 160 molecole con una grande quantità di variazioni chimiche basate su una struttura di scaffold comune (nucleo di resorcinyl polyketide isoprenilato), conosciute come fitocannabinoidi (Hanuš et al., 2016). Il THC (delta-9- tetraidrocannabinolo) e il CBD (cannabidiolo) sono di gran lunga le molecole più studiate. L'interesse della comunità scientifica durante il 20° secolo sul meccanismo d'azione del THC fu per lo più spinto dalle istituzioni antidroga, che miravano a dimostrare e far conoscere i suoi effetti dannosi. A questo proposito, mentre è vero che l'uso del THC, come qualsiasi altra molecola bioattiva, non è privo di effetti indesiderati(Ferland and Hurd, 2020), gli scienziati hanno lentamente apprezzato e studiato la grande varietà di potenziali applicazioni benefiche del THC, conosciute dall'umanità da millenni. Il THC è una molecola psicoattiva che regola la funzione neuronale principalmente attraverso i recettori cannabinoidi CB1, che sono stati identificati e clonati negli anni '90. L'interesse per il CBD è molto più recente ed ha modalità diverse. Il CBD è stato trascurato dagli scienziati come una molecola "non attiva": uno dei motivi principali di questa mancanza di interesse era l'assenza di un meccanismo d'azione mediato da recettore. Curiosamente, dall'ostracismo verso il CBD si è ultimamente passati a considerarla la molecola cannabinoide preferita in quanto: i) è un composto non psicotomimetico (non induce psicosi, caratteristica delle molecole che hanno come target i recettori CB1 come il THC); ii) il CBD esercita un effetto anticonvulsivo in varie malattie epilettiche refrattarie, e questo ha portato FDA ed EMA ad approvare il suo uso come medicinale; e iii) la mancanza di effetti pro-psicotici e di deterioramento cognitivo del CBD lo risparmia dalla maggior parte delle restrizioni che si applicano al THC. Il CBD è quindi un composto sicuro e molto ben tollerato ha visto una esplosione come molecola "d'oro" della Cannabis ed è diventato il composto preferito a livello commerciale, venendo aggiunto a molti prodotti per consumo umano e commestibili (prodotti sedicenti per la salute, integratori nutrizionali, e qualsiasi altra cosa si possa immaginare). In molti casi l'efficacia della maggior parte dei prodotti contenenti CBD di grado non farmaceutico, con concentrazioni di CBD basse o indeterminate, e assenza di dati su biodisponibilità e farmacodinamica, può essere messa in dubbio. Tuttavia, il CBD è una molecola interessante per i suoi potenziali usi terapeutici. Tra le altre azioni terapeutiche (Fernández-Ruiz et al., 2020), il CBD esercita un'azione anticonvulsivante nell'epilessia e allevia i sintomi di vari disturbi neuropsichiatrici. A questo proposito, è stato ripetutamente dimostrato che il CBD esercita azioni ansiolitiche, antidepressive e antipsicotiche in modelli preclinici di varie condizioni patologiche (Fig. 1A). Esistono indizi che il CBD allevi i sintomi della schizofrenia, del disturbo d'ansia sociale, delle comorbidità del disturbo dello spettro autistico e del disturbo da deficit di attenzione e iperattività negli esseri umani(Crippa et al., 2020). Infine, ma non meno importante, il CBD è attualmente esplorato, per citare alcuni esempi, per la gestione dei sintomi non motori delle malattie neurodegenerative (cioè il morbo di Parkinson e il morbo di Alzheimer).
Oltre alla modulazione acuta degli aspetti comportamentali, i cannabinoidi possono anche influenzare il destino delle cellule neurali, controllando le vie di segnalazione della sopravvivenza e della morte delle cellule. Il THC può esercitare azioni pro-sopravvivenza dei neuroni nelle malattie neurodegenerative e contrastare la morte cellulare indotta da insulti neuronali acuti (eccitotossicità, danno ipossico-ischemico, lesioni cerebrali traumatiche e altri)(Di Marzo et al., 2015). È interessante notare che il THC, agendo sui recettori CB1 situati nelle cellule progenitrici neurali, e il CBD, agendo attraverso meccanismi ancora poco chiari, promuovono la generazione di nuovi neuroni nel cervello dei topi adulti (Diaz-Alonso et al., 2012). Questo processo, noto come "neurogenesi adulta", avviene in aree cerebrali discrete (ippocampo e zona subventricolare) dei roditori, e la sua esistenza e rilevanza nel cervello umano è oggetto di controversie e dibattiti. Nel complesso, il "duetto" THC-CBD esercita azioni benefiche complementari negli stati patologici del sistema nervoso. Tuttavia, il meccanismo d'azione del CBD rimane in gran parte poco chiaro, anche se è stato dimostrato che modula diversi recettori e vie di segnalazione. In ogni caso, è importante tenere a mente che, almeno fino ad oggi, la maggior parte delle azioni terapeutiche dimostrate dei prodotti a base di cannabinoidi sono plausibilmente dovute al loro contenuto di THC(www.fundacion-canna.es/cannabis-vs-thc-son-realmente-tan-distintos).
Oltre al THC e al CBD, una nuova tendenza di ricerca mira a studiare l'impatto fisiologico di altri cannabinoidi minori presenti nella pianta [cioè il THCa (acido tetraidrocannabinolico), il CBDa (acido cannabidiolico), l'acido cannabigerolico (CBGa), la tetraidrocannabivarina (THCV), la cannabidivarina (CBDV), il cannabicromene (CBC) e la sua forma acida CBCa, ed altri ancora](Stone et al., 2020). I fitocannabinoidi sono prodotti da complesse vie metaboliche, e il cannabigerolo (CBG) è considerato il precursore comune della maggior parte di essi. Tipicamente, il THCa e altre forme acide dei cannabinoidi sono convertiti in molecole bioattive neutre mediante decarbossilazione termica. Sono in corso sforzi per chiarire se tali forme acide di cannabinoidi potrebbero essere di interesse terapeutico, dato che attualmente sono considerate prive di effetti psicoattivi indesiderati. Nuovi dati emergenti suggeriscono che CBG, CBDV e THCV, così come THCa e CBDa, potrebbero essere utili nel trattamento di alcuni sintomi di malattie neurologiche e psichiatriche (Fig. 1A). Anche se gli indizi disponibili sono ancora deboli e richiedono ulteriori indagini, il THCa è neuroprotettivo nei topi attraverso i recettori nucleari PPARγ ed è stato suggerito che eserciti azioni immunomodulanti. Attenua anche l'adiposità e le malattie metaboliche causate da obesità indotta.
Usando il modello preclinico dell'antagonismo del recettore del glutammato NMDA, i gruppi dell'Università di San Paolo (Brasile) e dell'Università Complutense (Spagna) stanno valutando le ipotizzate azioni antipsicotiche e ansiolitiche del THCa. Somministrando THCa ai roditori questi hanno recuperato l'interazione sociale e le funzioni cognitive, come valutate dal test di riconoscimento degli oggetti. È importante notare che il THCa è stato mostrato avere la stessa efficacia del più conosciuto farmaco antipsicotico clozapina. La ricerca in corso si concentra sulla determinazione del meccanismo molecolare d'azione del THCa, che può coinvolgere la regolazione del PPARγ, o la formazione di eteromeri del recettore CB1, in modo simile ad altri fitocannabinoidi come il CBD e il CBG. Per quanto riguarda le altre controparti acide dei cannabinoidi, il CBDa è neuroprotettivo, anche se agisce attraverso meccanismi diversi dal CBD. Inoltre, il CBDa previene l'emesi e il vomito, essendo più potente della sua forma neutra CBD. L'azione antinocicettiva dei cannabinoidi che hanno come target i recettori CB1 si osserva anche con il CBDa. Il CBGa ha dimostrato di indurre azioni sia anticonvulsive che proconvulsive in diversi modelli preclinici di epilessia.
Purtroppo, il campo delle applicazioni terapeutiche dei cannabinoidi è limitato dall'esigenza di permettere benefici economici per l'industria che vi sottende. Alcune compagnie sviluppano le loro strategie di guadagno attraverso la protezione della proprietà intellettuale dei metodi di disponibilità, isolamento e purificazione dei cannabinoidi. Altri hanno scelto di progettare nuove strutture di molecole modificando chimicamente i fitocannabinoidi per migliorare le loro azioni terapeutiche, migliorare la loro biodisponibilità e attenuare i loro effetti indesiderati (Fig. 1B). Tra gli altri, sono stati sviluppati derivati di CBD e CBG, come i composti EHP-101 e EHP-102, rispettivamente, che hanno portato all'identificazione di molecole di interesse che soddisfano alcuni di questi criteri. I composti EHP sono stati attivamente studiati per la loro azione terapeutica contro le conseguenze delle malattie neurodegenerative e neuroinfiammatorie. Ricerche preclinihe hanno potuto rilevare che il derivato CBG EHP-102, agendo tramite PPARγ è neuroprotettivo nei modelli della malattia di Huntington sui topi. L'effetto neuroprotettivo dell'EHP-102 si aggiunge alla sua azione proneurogenica, aumentando così la generazione di neuroni derivati dalla zona subventricolare che migrano verso lo striato in degenerazione. Da notare che questa molecola è efficace anche con somministrazione orale e, come agonista parziale del recettore, non induce i caratteristici effetti dannosi degli agonisti completi PPARγ . Un altro farmaco promettente, HU-580, basato sulla modifica dell'estere metilico del CBDa, è sotto studio per le sue azioni anti-nausea e ansiolitiche.
In sintesi, la ricerca sulle potenziali azioni terapeutiche dei cannabinoidi ha visto una crescita esponenziale negli ultimi decenni, ed è riuscita a identificare e dimostrare interessanti effetti benefici per THC e CBD. Mentre sono ancora necessari una maggiore e più solida ricerca di base, e soprattutto studi clinici standardizzati, per passare dalla ricerca preclinica alla terapia per queste molecole, vengono attivamente esplorate nuove strade per identificare se altri fitocannabinoidi minori sono di interesse a scopi biomedici. Prevediamo che, in futuro, il campo dei cannabinoidi beneficerà della diversità delle molecole fitoderivate e dimostrerà nuove applicazioni per la gestione dei disturbi del sistema nervoso e dei loro sintomi.
Ringraziamenti: Finanziamento Cyted della rete CannaLatan, Fundación Canna per il loro sostegno alla ricerca sul THCa, e Phytoplant Research (Spagna) per la gentile donazione di fitocannabinoidi purificati.
Bibliografia selezionata
Crippa JA, de Lima Osório F, Hallak J, Guimarães FS, Zuardi AW. Cannabinoids for the treatment of mental disorders. The Lancet Psychiatry 2020; 7: 125–126.
Diaz-Alonso J, Guzman M, Galve-Roperh I, Díaz-Alonso J, Guzmán M, Galve-Roperh I. Endocannabinoids via CB₁ receptors act as neurogenic niche cues during cortical development. Philos Trans R Soc Lond B Biol Sci 2012; 367: 3229-41.
Ferland JMN, Hurd YL. Deconstructing the neurobiology of cannabis use disorder. Nat Neurosci 2020; 23: 600-610.
Fernández-Ruiz J, Galve-Roperh I, Sagredo O, Guzmán M. Possible therapeutic applications of cannabis in the neuropsychopharmacology field. Eur Neuropsychopharmacol 2020: 1-18.
Hanuš LO, Meyer SM, Muñoz E, Taglialatela-Scafati O, Appendino G. Phytocannabinoids: A unified critical inventory. 2016
Di Marzo V, Stella N, Zimmer A. Endocannabinoid signalling and the deteriorating brain. Nat Rev Neurosci 2015; 16: 30-42.
Stone NL, Murphy AJ, England TJ, O'Sullivan SE. A systematic review of minor phytocannabinoids with promising neuroprotective potential. Br J Pharmacol 2020; 177: 4330-4352.