Par Tanja Bagar

Le Dr Tanja Bagar est une microbiologiste titulaire d'un doctorat en biomédecine. Elle a acquis une vaste expérience de la recherche en biotechnologie, en biologie moléculaire et en signalisation cellulaire dans des laboratoires en Slovénie, en Allemagne et au Royaume-Uni. Elle s'est principalement concentrée sur le système endocannabinoïde et les substances actives du cannabis/chanvre. Ses travaux ont conduit à la création de l'Institut international des cannabinoïdes (ICANNA), dont elle est directrice générale et présidente du conseil d'experts. Elle est également directrice adjointe et responsable de la R&D dans une société environnementale. Elle est également active dans la sphère universitaire. Elle donne des conférences dans le domaine de la microbiologie et est la doyenne du programme de maîtrise en écomédiation de la faculté Alma Mater Europaea.
L'autophagie est un programme d'autonettoyage évolutif qui se produit dans nos cellules. Le terme « autophagie » (des mots grecs auto « soi-même » et phagie « manger ») signifie littéralement « se manger soi-même ». Le mot a été choisi par le récipiendaire d'un prix Nobel, Christian de Duve : un chercheur belge en biologie cellulaire qui de concert avec deux collègues ont reçu le prix Nobel de physiologie ou médecine de 1974 pour leurs découvertes concernant l'organisation structurelle et fonctionnelle des cellules.
En 2016, le prix Nobel de physiologie ou médecine a été décerné à un chercheur japonais, Yoshinori Ohsumi, qui a étudié l'autophagie plus en profondeur. Durant le processus d'autophagie, les éléments cellulaires endommagés, les protéines inutilisées et les autres déchets cellulaires sont incorporés dans une vésicule, appelée autophagosome, tout comme vos déchets domestiques sont mis dans des sacs de poubelle. Chez l'humain, les vésicules sont transportées vers les lysosomes, un organite cellulaire. Ces organites ont une fonction similaire à celle d'un centre de recyclage : elles décomposent et recyclent les matières contenues dans les autophagosomes pour permettre aux éléments individuels d'être réutilisés. Dans les cellules humaines, l'autophagie débute par la formation d'une double membrane en forme de coupe appelée phagophore, qui capture les constituants à dégrader pour former un autophagosome sphérique à double membrane. La membrane extérieure de l'autophagosome se fusionne ensuite avec un lysosome pour former un autolysosome, ce qui entraîne la dégradation de l'autophagosome interne, de la membrane et des constituants qui y sont contenus.
Comment l'autophagie se produit-elle?
Grâce au travail de nombreux scientifiques pionniers, le concept de base de l'autophagie est maintenant compris. Ce processus a été observé principalement sous le microscope en présence de cellules en carence de nutriments, en état d'affamement. Plus les scientifiques observaient ce processus, plus il devenait évident que ce « simple » recyclage était en fait un processus cellulaire bien plus complexe. Bien que l'autophagie ait été étudiée principalement dans les cellules de la levure, il en est ressorti que le processus est en fait très similaire dans les cellules humaines.
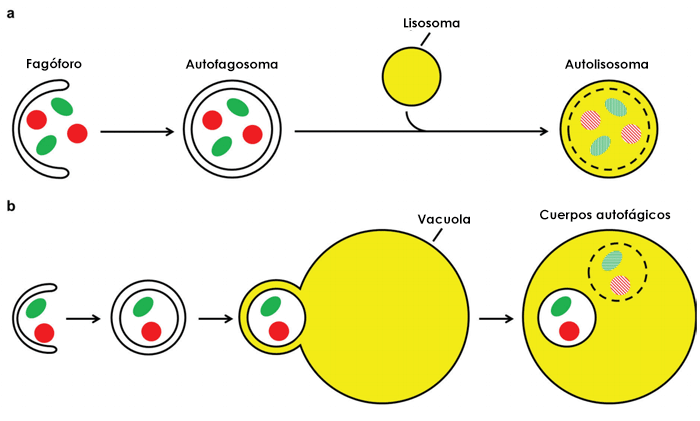
Figure 1 : Cheminement de l'autophagie dans les cellules humaines (a) et les cellules de la levure (b). Source : Frake, Becca & Rubinsztein, David. (2016). Yoshinori Ohsumi's Nobel Prize for the mechanisms of autophagy: From basic yeast biology to therapeutic potential. Journal of the Royal College of Physicians of Edinburgh. 46. 228-233. 10.4997/JRCPE.2016.403.
(a) Dans les cellules humaines, le phagophore capture la matière cytoplasmique pour former un autophagosome sphérique à double membrane. La membrane extérieure de l'autophagosome se fusionne ensuite avec un lysosome pour former un autolysosome, ce qui entraîne la dégradation de la membrane et des constituants qui y sont contenus.
(b) Le cheminement est similaire dans la levure, à la seule différence près que la membrane extérieure de l'autophagosome se fusionne avec la vacuole. Cette fusion forme au sein de la vacuole des corps autophagiques à membrane unique qui sont dégradés, avec leur contenu séquestré.
L'autophagie est un mécanisme de régulation de l'homéostasie cellulaire qui a un rôle de « préposé à l'entretien » dans des processus physiologiques normaux, car elle permet la réutilisation des constituants et de l'énergie dans les cellules. En dépit du fait qu'il s'agit d'un processus vital, il est néanmoins très strictement régulé. Il a été découvert que les cellules en carence de nutriments, c'est-à-dire qui étaient affamées, débutaient le processus d'autophagie. Apparemment, une carence en acides aminés, éléments constitutifs des protéines, dans des situations particulières augmentait l'autophagie. Ces découvertes sont l'une des raisons pour lesquelles le jeûne intermittent et le cyclage des protéines sont de plus en plus populaires et discutés. Tout d'abord, lorsque nous sautons un repas pour faire un jeûne de 12 à 16 heures, nous causons une carence en nutriments, et déclenchons ainsi l'autophagie dans notre corps. Ensuite, nous pouvons limiter notre apport en protéines pendant certains jours déterminés pour imiter une carence en acides aminés en vue de déclencher l'autophagie et de renouveler nos cellules et notre corps. Il a aussi été démontré que l'activité physique active des gènes qui déclenchent l'autophagie, ce qui renforce l'importance d'un mode de vie sain.
La première substance stimulant l'autophagie qui a été découverte était la rapamycine. La rapamycine a d'abord été identifiée comme étant un immunosuppresseur et utilisée pour traiter les patients subissant une greffe rénale. Des recherches subséquentes ont montré qu'elle a de nombreux bienfaits : réduction du risque d'infection à CMV chez les patients subissant une greffe rénale, amélioration de l'immunité contre les agents pathogènes et le cancer chez les souris, prolongation de l'espérance de vie des souris prédisposées à l'infection et protection des souris âgées contre les pneumonies. Ces effets sont en grande partie possibles grâce à l'autophagie. Certains éléments naturels, comme nous l'explorerons ultérieurement dans cet article, peuvent aussi induire l'autophagie.
Rôle de l'autophagie : santé et maladies
L'autophagie est essentielle à la santé, mais elle peut également jouer un rôle cytoprotecteur ou cytopathogène, selon les différents signaux et agents stressants auxquels sont exposées les cellules. Les chercheurs et les médecins espèrent qu'en modulant l'activité de l'autophagie nous serons en mesure d'influencer le développement des maladies; c'est ce qui explique pourquoi l'autophagie prend de l'importance sur le plan pharmacologique. L'autophagie a différents effets, mais le présent article explorera brièvement son rôle relativement aux infections et à l'immunité.
Lorsque le corps est infecté par des agents pathogènes, le système immunitaire de l'hôte s'active, et l'autophagie fait partie de la réponse immunitaire visant à éliminer les intrus. Pour qu'une réaction immunitaire réussie se produise, les bactéries et les virus intracellulaires doivent être détruits et éliminés. L'autophagie étant la dégradation de soi, le processus de dégradation de ces agents pathogènes est désigné comme la xénophagie (dégradation d'un corps étranger). Il pourrait s'agir de la plus ancienne forme de défense contre les agents pathogènes envahissants. L'autophagie est déclenchée en présence de la plupart des infections. Il a été découvert que des groupes de bactéries très communes et puissantes causant différentes maladies, comme A streptococcus, Salmonella typhimurium et Mycobacterium tuberculosis, sont dégradées et éliminées grâce à l'autophagie, comme le montre la figure 4. Des résultats similaires ont été démontrés pour de nombreuses autres bactéries pathogènes. Les effets de certains médicaments dépendent aussi de la régulation à la hausse de l'autophagie, notamment les effets antimycobactériens de la calcimycine utilisée contre les infections au Mycobacterium bovis. Certaines bactéries trouvent aussi le moyen d'éviter leur dégradation par autophagie. Dans le cas d'infections virales, l'autophagie peut avoir un rôle antiviral et potentiellement proviral. D'une part, les protéines autophagiques ciblent les corps viraux pour les dégrader et jouent aussi un rôle dans le déclenchement des réactions immunitaires innées et adaptatives contre les infections virales. D'autre part, comme c'est le cas pour certaines bactéries, certains virus sont capables d'interagir avec la machinerie autophagique et de la bloquer. Certains virus peuvent même utiliser des composants de la machinerie autophagique pour favoriser leurs propres croissance et réplication.
Il n'y a pas que l'élimination des agents pathogènes qui est régularisée par l'autophagie, mais également bon nombre d'autres aspects de l'immunité adaptative et innée, notamment la présentation de l'antigène, la cytokine et la production d'interférons, ce qui module l'inflammation et le développement de lymphocytes.
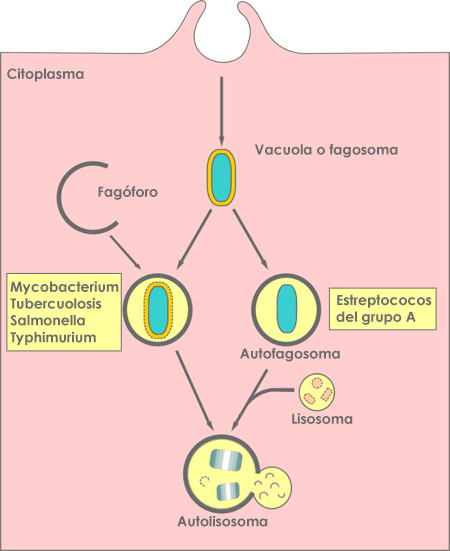
Figure 4 : Diagramme représentant les façons dont l'autophagie cible les bactéries intracellulaires. Source : Huang J, Brumell JH. Bacteria-autophagy interplay: a battle for survival. Nat Rev Microbiol. 2014;12(2):101-114. doi:10.1038/nrmicro3160.
Il est reconnu que les défauts dans le processus de régulation autophagique constituent des facteurs importants dans le développement de certaines maladies, notamment des maladies neurodégénératives, des cancers et des maladies métaboliques. La compréhension de l'autophagie suggère que, si nous savons comment activer le processus, et également le désactiver, au bon moment, nous serons en mesure d'avoir une influence sur le début et la progression d'une panoplie de maladies.
Autophagie et cannabinoïdes
Maintenant que l'on comprend l'importance de l'autophagie, une question se pose naturellement : comment les cannabinoïdes interagissent-ils avec le processus d'autophagie? De nombreuses plantes et leurs ingrédients sont reconnus pour induire l'autophagie, par exemple la bergamote, le thé vert, la cannelle et le resvératrol. Différentes études ont été menées en vue de déterminer le rôle des cannabinoïdes dans le processus d'autophagie. Il a été démontré que les cannabinoïdes sont essentiellement des agents inducteurs de l'autophagie tant dans les cellules saines que dans les cellules cancéreuses. Le déclenchement de l'autophagie peut être soit bénéfique soit problématique, selon l'état de la cellule. Bien qu'un niveau basal d'autophagie soit requis pour assurer la survie des cellules et des organismes, une activation prolongée de l'autophagie, ou un déclenchement de l'autophagie au mauvais moment, peut avoir des effets indésirables.
L'interaction entre le système endocannabinoïde et l'autophagie est déjà très importante dès les premières étapes de la vie. Immédiatement après la fertilisation, durant le développement de l'embryon, l'autophagie est grandement activée dans les ovocytes actifs, même avant la nidation. On suppose que l'autophagie est nécessaire tôt durant le développement embryonnaire pour assurer la dégradation des protéines maternelles et de l'ARNm qui ne sont plus nécessaires. On sait que l'autophagie est maintenue à des niveaux basaux dans les blastocystes la majeure partie du temps pendant les premiers jours de la gestation, mais que, chez les souris, elle est grandement réduite au quatrième jour, à l'approche de la nidation. À ce moment, les niveaux d'anandamide dans l'utérus baissent considérablement, ce qui montre une corrélation évidente entre la concentration d'anandamide et l'autophagie dans les blastocystes.
Ceci prouve que les endocannabinoïdes sont des agents régulateurs potentiels de l'autophagie. Puisque la production de quantités d'anandamide adéquates et l'induction de l'autophagie sont essentielles au développement embryonnaire et à la nidification chez les souris, une augmentation des niveaux d'anandamide pourrait mener au déclenchement de l'autophagie dans les embryons à des moments inopportuns, provoquant la mort cellulaire dans les embryons de souris. Des résultats semblables ont été constatés lors de l'ajout d'un agoniste sélectif des récepteurs CB1 (méthamphétamine), qui active également l'autophagie. Une quantité de 7 nm de méthamphétamine est reconnue comme étant une dose physiologique saine pour les embryons, tandis qu'une dose de 28 nm de méthamphétamine produit des effets indésirables sur la gestation chez les souris et les brebis. Si la méthamphétamine était injectée le quatrième jour, au moment où l'anandamide et l'autophagie sont généralement faibles, ou si la souris était exposée à un taux élevé de méthamphétamine dans les premiers jours de la gestation, l'autophagie était activée, la nidation n'avait pas lieu et les embryons mouraient.
Cela souligne à quel point il est important que l'autophagie se produise en temps opportun. Puisque l'autophagie et le système endocannabinoïde contribuent tous deux à la régularisation de l'homéostasie dans les cellules et dans le corps, leur lien n'est pas étonnant. Les endocannabinoïdes sont produits localement et sur demande, en fonction des signaux émis par l'environnement, ce qui en fait des inducteurs de l'autophagie rapides et idéaux.
Les phytocannabinoïdes peuvent aussi déclencher l'autophagie. Il a été démontré en 2009 que le THC cause la mort cellulaire dans les cellules de gliomes humains, dans les xénogreffes cancéreuses et dans les échantillons cancéreux humains, principalement par autophagie, mais non dans les cellules neuronales normales. Les cellules souches de gliome constituent une sous-population de cellules cancéreuses qui sont résistantes à la chimiothérapie. Le CBD déclenche le processus d'autophagie dans ces cellules et empêche leur prolifération et restreint leur capacité clonogénique. Par-dessus tout, lorsqu'ils sont combinés, le CBD et la carmustine, médicament utilisé en chimiothérapie, provoquent la mort cellulaire et freinent la croissance du cancer.
Dans les cellules de cancer du sein, le CBD augmente l'autophagie tandis que le Beclin-1 joue un rôle central dans son induction. L'effet du CBD était indépendant des récepteurs, principalement par l'entremise du stress oxydatif et de ses effets sur les mitochondries. Il a aussi été démontré que le O-1663 (agonistes des récepteurs CB2), un dérivé des cannabinoïdes, induisait également l'autophagie et l'apoptose dans les cellules de cancer du sein, particulièrement dans les cellules de cancer métastatique. Ainsi, le CBG, phytocannabinoïde ayant une affinité avec les récepteurs CB2, a un rôle important dans le traitement du cancer du sein.
Il a également été démontré que le CBD induit l'autophagie de façon dose-dépendante dans des cellules Caco-2 totalement différenciées, un modèle d'épithélium intestinal mature. Dans ce modèle, l'ACEA (agoniste des récepteurs CB1) et l'anandamide induisent également l'autophagie par l'entremise du récepteur cannabinoïde de type 1 et du récepteur CBD, de manière indépendante. Il pourrait s'agit d'un des mécanismes qui expliquent les usages thérapeutiques des cannabinoïdes dans le traitement des troubles inflammatoires intestinaux. Il a été démontré, dans un modèle avec des souris atteintes de troubles neurodégénératifs complexes, qu'une combinaison à parts égales de THC et de CBD (Sativex®) réduit les dépôts de protéines tau et d'amyloïde au niveau de l'hippocampe et du cortex cérébral, grâce à différents mécanismes dont la stimulation de l'autophagie, mettant ainsi en lumière le mécanisme derrière les propriétés neuroprotectrices des cannabinoïdes.
Conclusion
Dans les cellules saines, l'induction de l'autophagie contribue au bon fonctionnement des organes et au ralentissement du vieillissement. De façon intéressante, il a été démontré que le CBD protège les cellules du foie contre une stéatose sévère causée par l'alcool par l'entremise de plusieurs mécanismes, notamment l'activation et l'augmentation de l'autophagie. Pour ce qui est des cancers, il a été prouvé que la manière dont les cannabinoïdes interagissent avec les cellules cancéreuses dépend du type de tumeur, du cannabinoïde particulier et des caractéristiques des récepteurs cannabinoïdes, mais que, ultimement, cette interaction mène à l'autophagie. Toutefois, les conséquences de l'activation de l'autophagie ne sont pas encore pleinement comprises dans toutes les situations pathologiques. Dans certains cas, l'autophagie peut agir à titre de mécanisme provoquant la mort cellulaire ou comme mécanisme cytoprotecteur, selon le contexte cellulaire et la force et la durée des stimuli instigateurs. Il reste encore beaucoup de découvertes à faire à ce sujet, et nous espérons que nous obtiendrons plus de réponses dans un avenir proche concernant les moments opportuns et les façons d'utiliser les cannabinoïdes pour déclencher l'autophagie en présence de diverses maladies. Néanmoins, il n'y a aucun doute sur le fait que les cannabinoïdes favorisent l'activation de l'autophagie et un maintien accru de l'équilibre biochimique dans les cellules, les organes, les tissus et le corps et l'esprit dans leur ensemble.


