Par Tanja Bagar

Le Dr Tanja Bagar est une microbiologiste titulaire d'un doctorat en biomédecine. Elle a acquis une vaste expérience de la recherche en biotechnologie, en biologie moléculaire et en signalisation cellulaire dans des laboratoires en Slovénie, en Allemagne et au Royaume-Uni. Elle s'est principalement concentrée sur le système endocannabinoïde et les substances actives du cannabis/chanvre. Ses travaux ont conduit à la création de l'Institut international des cannabinoïdes (ICANNA), dont elle est directrice générale et présidente du conseil d'experts. Elle est également directrice adjointe et responsable de la R&D dans une société environnementale. Elle est également active dans la sphère universitaire. Elle donne des conférences dans le domaine de la microbiologie et est la doyenne du programme de maîtrise en écomédiation de la faculté Alma Mater Europaea.
Par Erhan Yarar

Le Dr Ehran Yarar œuvre en médecine translationnelle et compte plus de 20 ans d'expérience en matière d'oncologie pédiatrique et adulte, d'endocrinologie et, dernièrement, de psychiatrie. Diplômé de l'Université Hacettepe en Turquie, il détient plusieurs certificats de la faculté de médecine de l'Université Harvard, aux États-Unis. Il a participé à plusieurs collaborations médicales visant à traiter des patients de divers endroits dans le monde, dont les États-Unis, le Japon, Israël, l'Allemagne, la Turquie et Chypre. Il applique des principes de médecine alternative et complémentaire à la médecine conventionnelle. Il est membre émérite de l'International Cannabinoid Research Society et d'ICANNA. Le Dr Yarar possède une expérience dans l'utilisation de cannabinoïdes tels que le CBD, le THC et le CBG ainsi que d'un large spectre de terpènes auprès de ses patients. Il a rédigé de nombreux articles à ce sujet et sur la dépression, le diabète et d'autres problèmes de santé relatifs au système endocannabinoïde, et sur le potentiel des cannabinoïdes dans les protocoles de traitements médicaux.
Tous les êtres vivants suivent un rythme biologique appelé rythme circadien. Le nom est dérivé du latin circa, « autour », et dies, « jour ». Tous les êtres vivants sur Terre sont soumis à l'influence des cycles du jour et de la nuit et à la rotation de la Terre autour du Soleil. Nous ressentons tous ces changements externes réguliers et synchronisons nos activités physiques, comme les comportements, nos habitudes alimentaires, le métabolisme énergétique, les habitudes de repos, les mouvements régénératifs et les fonctions immunitaires dans un but bien précis : améliorer notre chance de survie.
Dès les premières formes de vie, nous pouvons constater la présence d'« horloges » intrinsèques omniprésentes qui ont su braver le processus évolutif et coordonnent encore aujourd'hui les changements physiologiques et biochimiques rythmiques qui se produisent en réponse à la lumière et à la noirceur, le stimulus le plus puissant et le plus dominant chez le mammifère. Des facteurs de l'environnement, appelés zeitgebers ou donneurs du temps, déterminent les différentes phases des cycles, en fonction du temps externe, dans un processus que l'on appelle l'entraînement. La réponse de l'horloge circadienne aux zeitgebers dépend de l'intensité du stimulus et de la phase circadienne en cours. Par conséquent, les zeitgebers peuvent avancer ou reculer l'horloge circadienne pour assurer une synchronisation avec la journée solaire.

Photo : Institute Icanna
La rythmicité circadienne est créée de façon endogène par des horloges moléculaires génétiquement encodées, ou « gènes-horloge », dont l'activité et les produits entraînent des changements cycliques sur le plan physiologique selon une périodicité d'environ une journée. L'horloge circadienne est contrôlée génétiquement et les mutations dans les gènes-horloge peuvent modifier les comportements rythmiques chez l'être humain, ainsi que chez les insectes, les plantes, les champignons et les bactéries. Essentiellement, l'horloge circadienne est un système intrinsèque et indépendant de comptabilisation du temps. Il est une succession d'autorégulations d'expression, d'accumulation et de dégradation des produits des gènes-horloge, qui crée à son tour des oscillations d'ordre biochimique, physiologique et comportemental. Chez les animaux, l'horloge moléculaire module l'expression des gènes dans tout le corps, contrôlant ainsi temporellement l'activité et les fonctions de différentes cellules et de différents organes. Une physiologie circadienne normale est créée par un réseau hiérarchique composé d'une horloge centrale et de plusieurs horloges périphériques.
Source: Patke A, Young MW, Axelrod S. Molecular
mechanisms and physiological importance of circadian
rhythms. Nat Rev Mol Cell Biol. 2020 Feb;21(2):67-84.
doi: 10.1038/s41580-019-0179-2.
Epub 2019 Nov 25. PMID: 31768006.
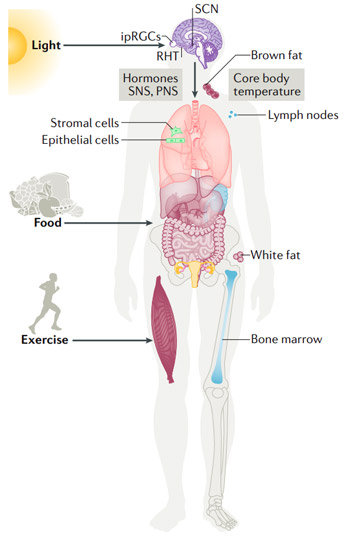
L'oscillateur central de notre horloge biologique circadienne se trouve dans le noyau suprachiasmatique (NSC), une toute petite région du cerveau dans l'hypothalamus, situé directement au-dessus du chiasma optique. L'oscillateur reçoit des informations sur le moment de la journée transmise par la lumière du jour par l'entremise de cellules photosensibles (ipRGC). Des horloges moléculaires ont été retrouvées non seulement dans le NSC, mais également dans presque tous les tissus et toutes les cellules du corps. C'est ce qu'on appelle les « horloges périphériques », qui ont notamment été observées dans le foie, les reins, le cœur, les muscles squelettiques, les tissus adipeux, et bien plus. Certaines exceptions incluent les cellules souches embryonnaires et les cellules souches pluripotentes induites, qui ne semblent pas présenter de cycles d'horloge moléculaire fonctionnels. Il existe une myriade de données soutenant que l'horloge centrale et les horloges biologiques sont essentielles au fonctionnement des organes et du corps dans son ensemble.
Les informations sur le moment de la journée sont envoyées au reste du corps par l'entremise d'hormones, du système nerveux sympathique (SNS), du système nerveux parasympathique (SNP), de la température corporelle centrale et du système endocannabinoïde. Il a été démontré que la résonance du temps interne et environnemental favorise la longévité, tandis qu'un cycle intrinsèque qui ne suit pas de cycles de lumière et de noirceur réduit l'espérance de vie.
Un désalignement de la périodicité interne avec le rythme environnemental nuit à la santé et à la condition physique de toutes les espèces, et les recherches montrent qu'une horloge déréglée est encore pire que de ne pas en avoir du tout.
L'interaction entre le système endocannabinoïde et le rythme circadien
Les organes et les tissus dans le corps qui ont des horloges circadiennes centrales et périphériques disposent également d'un système endocannabinoïde fonctionnel, et par le fait même, expriment des récepteurs cannabinoïdes ou produisent des endocannabinoïdes. L'expression du récepteur cannabinoïde 1 (CB1) a déjà été prouvée dans l'hypothalamus, y compris dans le NSC, et la présence d'autres composantes du système endocannabinoïde a été établie dans d'autres systèmes, organes et tissus du corps. Les endocannabinoïdes sont des molécules lipophiles qui servent de molécules de signal rétrograde et sont produites par la cellule postsynaptique. Lorsqu'ils pénètrent dans la fente synaptique, les endocannabinoïdes activent les récepteurs cannabinoïdes qui se trouvent sur la cellule présynaptique en vue de régulariser l'excitabilité neuronale. Des études récentes suggèrent que les astrocytes jouent un rôle important dans cette signalisation rétrograde comme mécanisme d'amélioration des réactions aux cannabinoïdes. Dans le NSC, oscillateur circadien central, les astrocytes jouent également un rôle actif dans l'intégration des informations sur le moment de la journée au sein du réseau du NSC.
La signalisation cannabinoïde endogène est reconnue comme un système de signalisation omniprésent qui coordonne la communication intercellulaire dans les organismes multicellulaires. Il a été démontré que le SEC et sa manipulation par des cannabinoïdes exogènes influent sur les cycles d'éveil et de sommeil, sur la régularisation de la température, sur la consommation de nourriture et le stockage des graisses, sur la régularisation par le système nerveux central des fonctions autonomes et endocriniennes, sur les comportements motivés par les récompenses, sur les fonctions gastro-intestinales, sur l'humeur et sur la perception sensorielle. Tous ces processus suivent un rythme circadien cyclique. Le SEC joue un rôle de modulateur et sert à maintenir l'homéostasie intracellulaire. Métaphoriquement, il est le gardien de notre équilibre interne.
Le SEC est interconnecté au rythme circadien à plusieurs égards; il sert parfois de régulateur « en amont », parfois « en aval ». La quantité d'endocannabinoïdes, leurs enzymes responsables de la synthèse et de la dégradation et leurs récepteurs présentent tous des changements diurnes au niveau des tissus, indiquant que le SEC est un régulateur circadien « en aval ». D'autre part, les cannabinoïdes exogènes et endogènes modulent bon nombre de processus physiologiques importants qui expriment un rythme circadien : sommeil-éveil, température corporelle, sécrétions endocrines de l'axe hypothalamo-hypophyso-surrénalien (HHS), apport en nourriture, apprentissage et mémoire et activité locomotrice. Ces découvertes indiquent que le SEC est un régulateur « en aval » des processus circadiens. Des recherches récentes suggèrent que le SEC sert de lien entre les régulateurs circadiens (horloges intrinsèques) du noyau suprachiasmatique et les réponses physiologiques qui en découlent.
De façon intéressante, le SEC en soi montre un comportement rythmique. Des comportements cycliques spécifiques ont été observés dans trois composantes majeures du SEC, soit la teneur en endocannabinoïdes dans les tissus, l'expression des récepteurs CB1 ainsi que les enzymes responsables de la dégradation et de la synthèse des endocannabinoïdes, ce qui vient renforcer son étroite corrélation avec le cycle circadien. Les oscillations diurnes rythmiques ont été bien documentées pour ce qui est de l'anandamide, où les humains en santé présentent une concentration plasmatique trois fois plus élevée à l'éveil que tout juste avant le coucher, une dynamique qui est déréglée en présence d'une privation de sommeil. L'anandamide se trouve généralement en faibles concentrations dans l'hippocampe en période de sommeil et en plus fortes concentrations en période d'éveil. Inversement, la concentration en 2-arachidonoylglycérol dans l'hippocampe est plus élevée durant les phases d'inactivité et plus faible pendant les périodes d'activité. Une dynamique semblable a également été observée au niveau du récepteur CB1. Lorsque les récepteurs cannabinoïdes sont activés, les réponses circadiennes du corps changent; l'activation du récepteur CB1 bloque les changements comportementaux du rythme circadien induit par la lumière et augmente la transmission de l'influx nerveux au sein du NSC en réduisant la libération d'acide gamma-aminobutyrique (GABA).
Incidences sur le sommeil
Il existe un lien intéressant entre les deux systèmes au sein du corps pinéal, une région du cerveau qui synthétise et libère la mélatonine, une hormone dérivée de la sérotonine qui module les phases du sommeil dans les cycles circadiens et saisonniers. Cette glande reçoit des signaux multisynaptiques du NSC, l'horloge circadienne centrale, et exprime toutes les composantes du SEC. Les récepteurs CB1 sont présents à la fois dans les pinéalocytes et sur les terminaux d'afférents sympathiques des glandes, et les enzymes responsables de la synthèse et de la dégradation des endocannabinoïdes du SEC sont exprimées dans la glande pinéale. Il est connu que les cannabinoïdes influencent la production de mélatonine, puisque le tétrahydrocannabinol (THC) et d'autres cannabinoïdes végétaux diminuent la synthèse de la mélatonine dans le corps pinéal par l'entremise d'un mécanisme indépendant des récepteurs CB1.
Il a été largement démontré que le SEC module l'organisation du sommeil. En effet, ce dernier joue un rôle dans le contrôle du cycle de sommeil et d'éveil. Des données indiquent que le SCE maintient et favorise l'état de sommeil. L'anandamide diminue l'état de veille et augmente l'état de sommeil lent et de sommeil paradoxal. Des études ont également démontré qu'une administration aiguë de THC entraîne une réduction de l'état de sommeil paradoxal et une augmentation de l'état de sommeil lent. Inversement, il a été observé qu'une administration chronique de THC diminue l'état de sommeil lent, sans aucun effet sur l'état de sommeil paradoxal. D'autres données attestant le rôle du SEC dans la régularisation du sommeil proviennent d'études démontrant que la densité du récepteur CB1 augmente considérablement durant la phase de rebond suivant une privation de sommeil. Cela indique qu'une hausse de l'activité du SEC au niveau du récepteur pourrait contribuer à la récupération homéostatique à la suite d'une privation de sommeil.
Dans le même sens que cette récente recherche, des données suggèrent que les cannabinoïdes pourraient s'avérer très utiles pour régler les troubles du sommeil. Le tétrahydrocannabinol (THC) peut diminuer la latence d'endormissement, mais pourrait également réduire la qualité du sommeil à long terme s'il est administré de façon chronique. Le cannabidiol (CBD) pourrait présenter un potentiel thérapeutique pour le traitement de l'insomnie, particulièrement pour les troubles du comportement en sommeil paradoxal et de somnolence diurne excessive. Les cannabinoïdes synthétiques, comme le nabilone et le dronabinol, ont montré leur efficacité dans le traitement de l'apnée obstructive du sommeil en raison de leurs effets régulateurs sur les formes d'apnées médiées par la sérotonine. Il a également été observé que le nabilone réduit les cauchemars associés à un trouble de stress post-traumatique et améliore la qualité du sommeil chez les patients souffrants de douleurs chroniques.
Conclusions :
De nombreux processus physiologiques sont régularisés par les rythmes circadiens, et de plus en plus de données montrent qu'un dysfonctionnement des rythmes circadiens, ou une désynchronisation de la rythmicité circadienne dans nos sociétés humaines modernes contribuent au développement de maladies. Le SEC semble être le pivot entre les horloges circadiennes et les réponses qui s'ensuivent, ce qui montre une relation bidirectionnelle entre la signalisation du SEC et les processus circadiens. Les cannabinoïdes, végétaux ou synthétiques, révèlent un immense potentiel pour régulariser les déséquilibres au niveau de la rythmicité circadienne et du sommeil. Grâce à leurs fonctions régulatrices fondamentales, les cannabinoïdes modulent l'activité du NSC et de l'oscillateur circadien central, en plus d'autres horloges circadiennes présentes dans tout le corps, contribuant ainsi à la santé générale et au bien-être.
Il existe une interaction particulièrement intéressante entre le SEC, la rythmicité circadienne et le sommeil. Puisque l'insomnie et d'autres troubles du sommeil, de plus en plus prévalents, sont associés à des risques pour la santé, le potentiel des cannabinoïdes dans le traitement des troubles du sommeil est d'une importance cruciale. L'insomnie est le trouble du sommeil le plus commun. Environ 30 % des adultes en souffrent, et environ 10 % souffrent d'une forme chronique. La prédominance de l'apnée obstructive du sommeil est aussi très élevée. On estime qu'environ 9 à 21 % des femmes et 24 à 31 % des hommes en souffrent. Des données suggèrent que les cannabinoïdes, utilisés au bon moment et dans une concentration et une composition appropriées, peuvent s'avérer très efficaces pour induire le sommeil et redresser l'architecture du sommeil, probablement en raison de leurs effets régulateurs sur les horloges circadiennes. Ils peuvent donc contribuer considérablement à la santé, au bien-être et à la productivité d'un individu, et considérant leur caractère généralisé, de la société dans son ensemble.
Références :
Vaughn LK, Denning G, Stuhr KL, de Wit H, Hill MN, Hillard CJ. Endocannabinoid signalling: has it got rhythm? Br J Pharmacol. 2010 Jun;160(3):530-43. doi: 10.1111/j.1476-5381.2010.00790.x. PMID: 20590563; PMCID: PMC2931554.
Acuna-Goycolea C, Obrietan K, van den Pol AN. Cannabinoids excite circadian clock neurons. J Neurosci. 2010 Jul 28;30(30):10061-6. doi: 10.1523/JNEUROSCI.5838-09.2010. PMID: 20668190; PMCID: PMC2927117.
Patke A, Young MW, Axelrod S. Molecular mechanisms and physiological importance of circadian rhythms. Nat Rev Mol Cell Biol. 2020 Feb;21(2):67-84. doi: 10.1038/s41580-019-0179-2. Epub 2019 Nov 25. PMID: 31768006.
Hablitz LM, Gunesch AN, Cravetchi O, Moldavan M, Allen CN. Cannabinoid Signaling Recruits Astrocytes to Modulate Presynaptic Function in the Suprachiasmatic Nucleus. eNeuro. 2020 Feb 13;7(1):ENEURO.0081-19.2020. doi: 10.1523/ENEURO.0081-19.2020. PMID: 31964686; PMCID: PMC7029187.
Babson KA, Sottile J, Morabito D. Cannabis, Cannabinoids, and Sleep: a Review of the Literature. Curr Psychiatry Rep. 2017 Apr;19(4):23. doi: 10.1007/s11920-017-0775-9. PMID: 28349316.