Par Ismael Galve-Roperh

Ismael Galve-Roperh, biochimiste et biologiste moléculaire ayant plus de 20 ans d'expérience dans la recherche sur les cannabinoïdes. Il a apporté des contributions importantes telles que la découverte du rôle antitumoral de la signalisation cannabinoïde, ses effets neuroprotecteurs dans les maladies neurodégénératives et l'impact de ces composés sur le neurodéveloppement.
Ismael Galve-Roperh1, Alline Campos2, Francisco Guimaraes2, Manuel Guzmán1
1 Faculté de biologie et Instituto Universitario de Investigación Neuroquímica de l'Université Complutense, 28040 Madrid (Espagne), Centro de Investigación Biomédica en Red sobre Enfermedades Neurodegenerativas (CIBERNED) et Instituto Ramón y Cajal de Investigación Sanitaria (IRYCIS);
2 Département de neuropharmacologie, Université de São Paulo, Ribeirão Preto, Brésil
Le premier réseau de recherche sur les cannabinoïdes subventionné par des fonds publics en Amérique latine (le CannaLatan, www.cyted.org/es/cannalatan) a récemment vu le jour. Le réseau est composé de chercheurs universitaires et d'entreprises pharmaceutiques de plusieurs pays. CannaLatan vise à promouvoir et à amplifier les résultats obtenus par les différents partenaires du consortium qui contribuent à la recherche collaborative et qui élaborent des projets éducatifs. Le réseau CannaLatan s'engage à explorer les effets thérapeutiques potentiels des phytocannabinoïdes jusqu'ici peu étudiés et des molécules à base de cannabinoïdes nouvellement découvertes ainsi qu'à clarifier leurs effets indésirables. Nous discutons ici de l'un des projets en cours lancés par CannaLatan avec le soutien financier de la Fundación Canna (www.fundacion-canna.es/), dans lequel nous étudions les effets antipsychotiques et cognitifs des formes acides des phytocannabinoïdes, soit le THCa (Figure 1A).
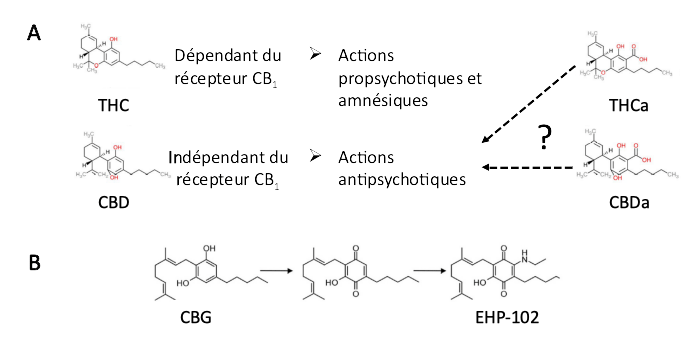
Légende des figures. A – Actions différentielles des formes neutres et acides des deux phytocannabinoïdes les plus étudiés : le THC et le CBD. B – Utilisation de modèles structurels de molécules de phytocannabinoïdes pour la création de molécules thérapeutiques améliorées, illustrée ici avec les dérivés quinones du CBG.
La plante Cannabis sativa contient plus de 160 molécules présentant une grande diversité de modifications chimiques selon un échafaudage moléculaire commun (isoprenylated resorcinyl polyketide core en anglais), aussi connu sous le nom de phytocannabinoïdes (Hanuš et coll., 2016). Le THC (delta-9-tétrahydrocannabinol) et le CBD (cannabidiol) sont de loin les molécules les plus étudiées. Au 20e siècle, l'intérêt de la communauté scientifique pour les mécanismes d'action du THC a surtout été motivé par les institutions antidrogues, qui visaient à en démontrer et à en communiquer les effets négatifs. À cet égard, bien que l'usage du THC, comme toute autre molécule bioactive, n'est pas sans effets indésirables (Ferland and Hurd, 2020), les scientifiques ont progressivement accepté et étudié la grande variété d'applications potentiellement positives du THC, connu de l'homme depuis des millénaires. Le THC est une molécule psychoactive qui a pour effet de régulariser la fonction neuronale, principalement par l'intermédiaire des récepteurs cannabinoïdes CB1, qui ont été identifiés et clonés dans les années 1990. En comparaison, l'intérêt porté envers le CBD est beaucoup plus récent. Le CBD a été négligé par les scientifiques, qui le considéraient comme une molécule « non active ». C'est là l'une des principales raisons de ce manque d'intérêt, l'absence d'un mécanisme contrôlé par des récepteurs. Curieusement, le CBD, longtemps délaissé, est devenu la molécule cannabinoïde favorite : i) il s'agit d'un composé non psychotomimétique (c.-à-d., qui n'induit pas la psychose, un effet caractéristique des molécules qui ciblent les récepteurs CB1, comme le THC); ii) le CBD a des effets anticonvulsivants chez les personnes atteintes d'épilepsie réfractaire; et iii) l'absence d'effets propsychotiques et cognitifs négatifs du CBD fait en sorte qu'il n'est pas soumis à la plupart des restrictions d'accès qui s'appliquent au THC. Par conséquent, le CBD est un composé sécuritaire et très bien toléré dont la popularité a explosé à titre de molécule de Cannabis par excellence. Il est d'ailleurs devenu le composé favori pour la commercialisation et est aujourd'hui ajouté à de nombreux produits comestibles et destinés à la consommation humaine (produits ayant des bienfaits présumés pour la santé, suppléments alimentaires et toutes sortes d'autres produits). Il faut toutefois exercer une certaine prudence et remettre en question l'efficacité de la plupart des produits contenant du CBD, ceux qui ne sont pas de qualité pharmaceutique, en concentrations faibles ou indéterminées et dont les données relatives à la biodisponibilité et la pharmacodynamie sont absentes. Toutefois, le CBD constitue une molécule intéressante pour ses utilisations thérapeutiques prétendues. Parmi ses autres actions thérapeutiques (Fernández-Ruiz et coll., 2020), le CBD a des effets anticonvulsivants chez les patients atteints d'épilepsie et soulage plusieurs symptômes des troubles neuropsychiatriques. À cet égard, il a été démontré à maintes reprises que le CBD exerce des actions anxiolytiques, antidépressives et antipsychotiques dans le cadre de modèles précliniques pour divers troubles pathologiques (Fig. 1A). Il existe des preuves modérées que le CBD soulage les symptômes de la schizophrénie, du trouble d'anxiété sociale, des comorbidités du trouble du spectre autistique et du trouble déficitaire de l'attention avec hyperactivité chez les humains (Crippa et coll., 2020). Enfin, les propriétés du CBD sont explorées pour découvrir si celui-ci pourrait aider à gérer les symptômes non moteurs de maladies neurodégénératives, comme la maladie de Parkinson et la maladie d'Alzheimer, pour ne nommer que quelques exemples.
En plus de sa capacité à moduler efficacement certains aspects comportementaux, les cannabinoïdes peuvent aussi influencer le sort des cellules neuronales, en contrôlant les voies de signalisation de survie/mort cellulaire. Le THC a des actions prosurvie sur les neurones en présence d'une maladie neurodégénérative et freine la mort cellulaire induite par des insultes neuronales aiguës (excitotoxicité, dommages hypoxiques ischémiques, traumatismes crâniens, etc.) (Di Marzo et coll., 2015). De manière intéressante, le THC, qui agit sur les récepteurs CB1 situés dans les cellules neuronales progénitrices, et le CBD, qui agit selon des mécanismes encore peu définis à ce jour, favorisent la génération de nouveaux neurones dans le cerveau de la souris adulte (Diaz-Alonso et coll., 2012). Ce processus, appelé « neurogenèse adulte », se produit dans des régions distinctes du cerveau (hippocampe et zone sous-ventriculaire) des rongeurs, et son existence et sa pertinence dans le cerveau humain font l'objet de controverses et de débats. Dans l'ensemble, le duo THC-CBD exerce des actions bénéfiques complémentaires sur les états pathologiques du système nerveux. Toutefois, le mécanisme d'action du CBD demeure peu clair, bien qu'il ait été démontré qu'il a la capacité de moduler plusieurs récepteurs et voies de signalisation. Dans tous les cas, il est important de garder à l'esprit que, pour le moment du moins, la plupart des actions thérapeutiques démontrées des produits à base de cannabinoïdes sont vraisemblablement produites grâce à leur teneur en THC (https://www.fundacion-canna.es/fr/cannabis-vs-thc-are-they-really-so-different).
En plus du THC et du CBD, une nouvelle vague ou tendance dans la recherche vise à explorer les effets psychologiques d'autres cannabinoïdes mineurs présents dans la plante (par exemple, l'acide tétrahydrocannabinolique [THCa], l'acide cannabidiolique [CBDa], l'acide cannabigérolique [CBGa], le tétrahydrocannabivarin [THCV], le cannabidivarine [CBDV], le cannabichromène [CBC] et sa forme acide, le CBCa) (Stone et coll., 2020). Les phytocannabinoïdes sont produits par des voies métaboliques complexes, et le cannabigérol (CBG) est considéré comme le précurseur commun de la plupart des phytocannabinoïdes. Typiquement, le THCa et d'autres formes acides de cannabinoïdes sont convertis dans leurs formes moléculaires bioactives neutres lorsqu'ils sont soumis à un processus de décarboxylation induit par la chaleur. Des efforts scientifiques sont en cours afin de déterminer si ces formes acides de cannabinoïdes pourraient avoir un intérêt thérapeutique, car à ce jour, on considère qu'elles n'auraient aucun effet psychoactif indésirable. De nouvelles données émergentes suggèrent que le CBG, le CBDV et le THCV, ainsi que le THCa et le CBDa, pourraient s'avérer utiles pour traiter les symptômes de maladies d'ordre neurologique et psychiatrique (Fig. 1A). Bien que les preuves disponibles à ce jour soient encore minimes et nécessitent une étude plus approfondie, le THCa exerce une action neuroprotectrice chez la souris en agissant sur les récepteurs nucléaires PPARγ et il a été suggéré qu'il aurait des propriétés immunorégulatrices. Il aide aussi à atténuer l'adiposité et la maladie métabolique provoquée par l'obésité causée par l'alimentation.
En utilisant le modèle préclinique de l'antagoniste de récepteurs NMDA, les groupes de l'Université de São Paulo (Brésil) et de l'Université Complutense (Espagne) évaluent actuellement les propriétés antipsychotiques et anxiolytiques putatives du THCa. L'administration de THCa chez les rongeurs a permis de contrecarrer les déficiences dans les fonctions cognitives et les interactions sociales, selon une évaluation réalisée dans le cadre du nouveau test de reconnaissance d'objet. Il est important de noter que le THCa était tout autant efficace que la clozapine, la médication antipsychotique typique. Des recherches en cours visent à définir le mécanisme d'action moléculaire du THCa, qui pourrait impliquer la régularisation du PPARγ, ou la formation d'hétéromères de récepteurs CB1, comme c'est le cas d'autres phytocannabinoïdes comme le CBD et le CBG. Pour ce qui est des autres homologues acides de cannabinoïdes, le CBDa a des effets neuroprotecteurs, bien qu'il agisse selon des mécanismes différents de ceux du CBD. De plus, le CBDa empêche les vomissements de manière plus puissante que sa forme neutre, soit le CBD. L'action antinociceptive des cannabinoïdes qui ciblent le récepteur CB1 est également étudiée pour le CBDa. Il a été démontré que le CBGa induit des actions anticonvulsives ou proconvulsives dans différents modèles précliniques axés sur l'épilepsie.
Malheureusement, le domaine des applications thérapeutiques à base de cannabinoïdes est dicté par les exigences de l'industrie en coulisse qui cherche toujours à augmenter ses profits. Certaines entreprises créent leur stratégie financière autour de la protection de la propriété intellectuelle quant aux méthodes d'administration, d'isolation et de purification des cannabinoïdes. D'autres ont choisi de concevoir de nouvelles structures moléculaires en procédant à des modifications chimiques des phytocannabinoïdes en vue d'améliorer leurs actions thérapeutiques, d'améliorer leur biodisponibilité et d'amoindrir leurs effets indésirables (Fig. 1B). Notamment, des dérivés du CBD et du CBG, comme les composés EHP-101 et EHP-102, respectivement, ont été développés, ce qui a mené à l'identification de molécules d'intérêt qui répondent à ces critères. Les composés EHP ont été activement étudiés pour leurs propriétés thérapeutiques qui pourraient aider à contrer les conséquences de maladies neurodégénératives et neuroinflammatoires. Des recherches précliniques subséquentes ont permis de constater que le EHP-102, dérivé du CBG, en agissant par l'intermédiaire du PPARγ a des propriétés neuroprotectrices dans des modèles sur les souris axés sur la maladie de Huntington. Les effets neuroprotecteurs du EHP-102, combinés à son action proneurogénique, améliorent la génération de neurones dérivés de la zone sous-ventriculaire qui migrent vers le striatum dégénératif. Il convient de noter que cette molécule est efficace lorsqu'elle est administrée par voie orale et, en tant qu'agoniste partiel du récepteur, n'induit pas les effets nuisibles caractéristiques des agonistes complets du récepteur PPARγ. Autre médicament prometteur, le HU-580, créé en modifiant l'ester méthylique dans le CBDa, est actuellement étudié pour ses actions antinauséeuses et anxiolytiques.
Pour résumer, la recherche sur les potentielles actions thérapeutiques des cannabinoïdes a connu un essor exponentiel au cours des dernières décennies et a réussi à identifier et à démontrer certains effets bénéfiques intéressants du THC et du CBD. Bien que des recherches plus fondamentales et plus approfondies, et surtout, des essais cliniques normalisés soient de mise pour faire passer la recherche préclinique du laboratoire au chevet du patient en ce qui a trait à ces molécules, de nouvelles avenues sont activement explorées en vue de déterminer si d'autres phytocannabinoïdes mineurs sont d'intérêt sur le plan biomédical. Nous prédisons que, dans l'avenir, le domaine des cannabinoïdes tirera avantage de la diversité des molécules dérivées de la plante et parviendra à démontrer de nouvelles applications quant à la gestion des troubles du système nerveux et aux symptômes connexes.
Remerciements : Cyted pour le financement du réseau CannaLatan, la Fundación Canna pour son soutien dans les recherches sur le THCa et Phytoplant Research (Espagne) pour sa généreuse contribution en phytocannabinoïdes purifiés.
Références
Crippa JA, de Lima Osório F, Hallak J, Guimarães FS, Zuardi AW. Cannabinoids for the treatment of mental disorders. The Lancet Psychiatry 2020; 7: 125–126.
Diaz-Alonso J, Guzman M, Galve-Roperh I, Díaz-Alonso J, Guzmán M, Galve-Roperh I. Endocannabinoids via CB₁ receptors act as neurogenic niche cues during cortical development. Philos Trans R Soc Lond B Biol Sci 2012; 367: 3229-41.
Ferland JMN, Hurd YL. Deconstructing the neurobiology of cannabis use disorder. Nat Neurosci 2020; 23: 600-610.
Fernández-Ruiz J, Galve-Roperh I, Sagredo O, Guzmán M. Possible therapeutic applications of cannabis in the neuropsychopharmacology field. Eur Neuropsychopharmacol 2020: 1-18.
Hanuš LO, Meyer SM, Muñoz E, Taglialatela-Scafati O, Appendino G. Phytocannabinoids: A unified critical inventory. 2016
Di Marzo V, Stella N, Zimmer A. Endocannabinoid signalling and the deteriorating brain. Nat Rev Neurosci 2015; 16: 30-42.
Stone NL, Murphy AJ, England TJ, O'Sullivan SE. A systematic review of minor phytocannabinoids with promising neuroprotective potential. Br J Pharmacol 2020; 177: 4330-4352.


