Par Guillermo Moreno-Sanz

Dr. Moreno-Sanz est l'auteur de plus de 30 articles scientifiques et détient 3 brevets décrivant le rôle du système endocannabinoïde dans la perception de la douleur. Diplômé de biochimie et de chimie organique de l'Université de Zaragoza, il obtient son doctorat en neuroscience à l'Université Complutense de Madrid, en Espagne. Il acquiert une vaste expérience internationale grâce à ses bourses longue durée aux Pays-Bas, en Italie et aux États-Unis, bâtissant la majeure partie de sa carrière académique à l'Université de la Californie, à Irvine, où il découvre une nouvelle classe d'analgésiques cannabinoïdes avec un fort potentiel clinique. En 2017, il agit à titre de consultant pour les Académies nationales des sciences des États-Unis dans la préparation du rapport intitulé The health effects of cannabis and cannabinoids (Les effets du cannabis et des cannabinoïdes sur la santé). Il fonde ensuite Abagune Research pour offrir des conseils scientifiques et des solutions de R/D à l'industrie internationale du cannabis. En 2020, il assume la direction scientifique et médicale de Khiron Life Sciences en Europe.
La plupart des patients qui décident de commencer un traitement à base de cannabis ou de ses dérivés le font pour soulager des symptômes associés à la douleur chronique. Il s'agit d'une constante qui revient dans toutes les études menées dans les pays qui ont adopté un programme d'accès au cannabis à des fins médicales, une réalité qui est en train de changer depuis tout récemment en raison d'un nombre croissant de patients qui ont recours au cannabis pour soulager des troubles liés à l'anxiété et au stress.
C'est pourquoi il est si choquant pour ceux qui demandent la réglementation de l'usage thérapeutique du cannabis que des associations médicales de premier plan, comme l'International Association for the Study of Pain (IASP), déconseillent l'utilisation des cannabinoïdes dans le traitement de la douleur sur la base des preuves existantes (ou inexistantes). Ce débat sur l'existence ou non de preuves scientifiques suffisantes pour recommander l'usage thérapeutique du cannabis s'est infiltré au sein de la sous-commission du Congrès qui prépare actuellement une proposition visant à réglementer l'usage médicinal du cannabis en Espagne et qui, s'éloignant de son mandat qui consiste à « analyser les expériences de réglementation du cannabis à des fins médicales », semble s'engager dans des eaux troubles dans lesquelles on peut facilement se perdre(1).
Qu'est-ce que la médecine fondée sur les preuves?
Lorsqu'un médecin prend une décision thérapeutique, il se fonde généralement sur sa propre expérience clinique, combinée aux meilleures données objectives actuelles, toujours en tenant compte des préférences des patients. Ces données scientifiques à partir desquelles une intervention thérapeutique est établie sont ce que nous appelons des preuves médicales. Bien qu'elle semble logique et bien établie, la médecine fondée sur les preuves est relativement jeune, puisqu'elle a été développée dans les années 1970 avec l'essor des essais cliniques randomisés pour l'approbation et la commercialisation des médicaments. L'un des pionniers de la médecine fondée sur les preuves est l'épidémiologiste clinique britannique Archie Cochrane, qui a défini trois concepts liés à la prise de décision en matière de traitement : l'efficacité potentielle, l'efficacité réelle et l'efficience. L'efficacité potentielle détermine si un traitement est plus bénéfique que néfaste dans des conditions contrôlées, par exemple dans le cadre d'un essai clinique (est-ce que ça peut fonctionner?). L'efficacité réelle évalue si un traitement est plus bénéfique que néfaste lorsqu'il est administré dans des conditions normales de pratique médicale (fonctionne-t-il dans le monde réel?). L'efficience mesure les résultats d'une intervention par rapport aux ressources qu'elle nécessite (en vaut-elle la peine?)(2). Toutefois, ce n'est qu'au début des années 1990 qu'un changement du modèle d'éducation et de pratique médicales a été initié, que l'idéologie du mouvement de la médecine fondée sur les preuves a été formulée et que les méthodologies utilisées pour déterminer la qualité des preuves scientifiques ont été gravées dans la pierre(3). Ainsi, en 1993, l'organisation à but non lucratif Cochrane a été fondée pour, grâce au travail de chercheurs bénévoles de partout dans le monde, examiner de manière rigoureuse et systématique les interventions en matière de santé dans le but de faciliter la prise de décision des professionnels de la santé, des patients et des décideurs politiques en matière de santé, conformément aux principes de la médecine fondée sur les preuves.
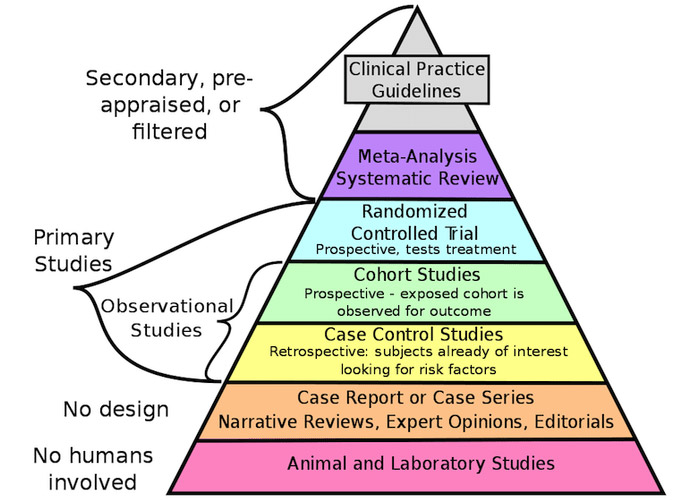
Légende de la figure : Pyramide de la qualité des preuves scientifiques (inspirée de la référence 3).
Preuves scientifiques de première qualité recherchées!
Comme l'illustre la « pyramide de la qualité des preuves scientifiques » (voir la figure inspirée de la référence 3), les données considérées comme étant de la plus grande qualité proviennent des résultats d'« études expérimentales » telles que les essais cliniques randomisés (ECR), les méta-analyses et les revues systématiques. En deuxième position se trouvent les données issues des « études observationnelles », telles que les études de cohortes ou les cas cliniques, qui peuvent être très variées dans leur conception et leur typologie. Puis, au bas de la pyramide, on retrouve les preuves cliniques de très faible qualité pour déterminer une option thérapeutique, telles que les revues narratives, les avis d'experts et les études sur les animaux.
Les ECR sont des études menées chez l'humain en phases progressives, d'abord auprès de volontaires en santé, ensuite auprès de patients, dont l'objectif est de déterminer l'efficacité potentielle (est-ce que ça peut fonctionner?) d'un médicament ou d'un dispositif médical pour un trouble de santé particulier ou une « indication » précise. Ces études font partie du processus d'enregistrement et d'obtention de l'autorisation nécessaire pour commercialiser le produit pour cette indication. Ce processus est extrêmement coûteux, tant en temps qu'en ressources financières, et s'applique généralement aux nouveaux médicaments protégés par la propriété intellectuelle qui permet au commanditaire de l'ECR de récupérer son investissement au fil des années de vente du produit. Il s'agit de l'une des principales raisons pour lesquelles les dérivés du cannabis, qui sont difficiles à breveter et commercialisés sous forme de formulations magistrales, présentent peu d'intérêt pour le développement de médicaments selon le processus pharmaceutique classique. Les ECR sont également essentielles pour déterminer l'innocuité d'un nouveau médicament. Les premières études sur des cas humains, dans lesquels des médicaments dont la toxicité a été exclue dans des cellules et chez des animaux sont administrés pour la première fois à des humains en bonne santé, revêtent une importance particulière. Utilisé par l'homme depuis plus de 5 000 ans, le cannabis présente un profil pharmacologique relativement sécuritaire, avec des effets indésirables généralement faibles ou atténuables. Les méta-analyses sont des outils statistiques qui permettent de combiner les résultats de différentes études en vue d'analyser les mêmes variables et, par conséquent, peuvent fournir plus d'informations ou avoir une plus grande portée que chacune des études cliniques individuelles desquelles sont issues les données. Enfin, les revues systématiques fournissent une synthèse structurée des preuves existantes publiées sous différents formats à l'aide d'une méthodologie rigoureuse.
Les études observationnelles quant à elles sont celles dans lesquelles les chercheurs n'interfèrent pas avec ce qui se passe dans la pratique clinique de routine. C'est-à-dire qu'ils se limitent à observer et à recueillir des informations, mais ne peuvent contrôler aucune variable, déterminer les doses ou les temps d'administration, randomiser les patients, ni les affecter à un groupe placebo. Cependant, ces types d'études ont gagné en pertinence au cours des dernières années en raison de leur capacité à recueillir des preuves ou des données dans le monde réel, par opposition aux critères d'inclusion et d'exclusion des ECR, qui font que les participants à l'étude ne sont souvent pas représentatifs des populations cliniques plus vastes. C'est pourquoi on considère de plus en plus que les études dans le monde réel peuvent fournir des informations complémentaires à celles obtenues dans le cadre des ECR, recueillies dans des dossiers médicaux électroniques sur de longues périodes, concernant l'innocuité et l'efficacité réelle à long terme d'un traitement (fonctionne-t-il dans le monde réel?) au sein de populations importantes et hétérogènes, ainsi que les habitudes de prescription ou les incidences médicales et économiques de son utilisation(4).
Qu'en est-il du cannabis à des fins médicales?
Comme nous l'avons vu, les preuves considérées comme étant de haute qualité selon les tableaux de la loi sur la médecine fondée sur les preuves proviennent des ECR et de leurs méta-analyses. À ce jour, une soixantaine d'ECR ont été publiées sur l'utilisation des cannabinoïdes dans le traitement de la douleur, avec une hétérogénéité considérable en termes de taille de population, d'indication, de présentation (des fleurs de cannabis en inhalation aux produits de THC synthétique par voie orale), de posologies, de rations de THC et de CBD, de voie d'administration, de durée de traitement (de quelques heures à plusieurs mois) et de résultats mesurés, de sorte que, comme on pouvait s'y attendre, les résultats obtenus sont contradictoires. Dans un effort pour consolider ces résultats, des revues systématiques et des méta-analyses des données disponibles ont commencé à voir le jour. De 2010 à 2019, 57 études de ce genre ont été publiées, ce qui n'a fait qu'intensifier le débat en raison de leur vaste éventail de conclusions, allant de celles qui trouvent des preuves évidentes de l'efficacité du cannabis à celles qui affirment tout le contraire. Il faut garder à l'esprit que la plupart des ECR visant à commercialiser les deux médicaments autorisés à base de cannabis ou de cannabinoïdes, soit Sativex et Epidolex, ne cherchaient pas à caractériser ses produits au sein des populations souffrant de douleurs chroniques, mais plutôt chez les personnes atteintes de sclérose en plaques et d'épilepsie réfractaire pédiatrique, respectivement. Parallèlement, les pays où l'accès au cannabis à des fins thérapeutiques est réglementé commencent à accumuler des données du monde réel qui suggèrent que les patients souffrant de douleurs chroniques constatent une nette amélioration de leur qualité de vie lorsqu'ils intègrent des formulations à base de cannabis médicinal à leur plan de traitement. Sur la base de ces observations, et contrairement à la déclaration de l'IASP, la European Pain Federation recommande de considérer le cannabis à des fins médicales comme une thérapie de troisième ligne pour la douleur neuropathique chronique, tandis que, pour tous les autres cas de douleur chronique, l'utilisation de dérivés du cannabis devrait être considérée comme un essai thérapeutique individuel(1). Cela signifie que, si les traitements approuvés ont échoué, et après une analyse minutieuse et une évaluation multidisciplinaire, un médecin devrait pouvoir prescrire du cannabis médicinal à ses patients s'il juge que ce traitement pourrait leur être bénéfique. Il semble que, petit à petit, et grâce à l'accumulation de preuves issues du monde réel auprès de milliers de patients qui tirent déjà parti d'un traitement à base de dérivés de cannabis, les questions de Cochrane trouvent des réponses. Bientôt, la question ne sera plus de savoir si le cannabis médicinal présente une efficacité potentielle, mais plutôt s'il est efficient. Pour boucler la boucle de l'accès au cannabis à des fins médicales et éviter les menaces que présentent le marché noir ou la légalisation du cannabis à des fins récréatives, il sera primordial que le coût du traitement soit couvert ou subventionné pour les patients qui en ont besoin. Comme il se doit.
Références :
1. Eisenberg E, Morlion B, Brill S, Häuser W. Medicinal cannabis for chronic pain: The bermuda triangle of low-quality studies, countless meta-analyses and conflicting recommendations. Eur J Pain. 2022 Apr 6;
2. Haynes B. Can it work? Does it work? Is it worth it? The testing of healthcareinterventions is evolving. BMJ. 1999 Sep 11;319(7211):652–3.
3. Evidence-based medicine. A new approach to teaching the practice of medicine. JAMA. 1992 Nov 4;268(17):2420–5.
4. Blonde L, Khunti K, Harris SB, Meizinger C, Skolnik NS. Interpretation and Impact of Real-World Clinical Data for the Practicing Clinician. Adv Ther. 2018 Nov 1;35(11):1763–74.