Par Guillermo Moreno-Sanz

Dr. Moreno-Sanz est l'auteur de plus de 30 articles scientifiques et détient 3 brevets décrivant le rôle du système endocannabinoïde dans la perception de la douleur. Diplômé de biochimie et de chimie organique de l'Université de Zaragoza, il obtient son doctorat en neuroscience à l'Université Complutense de Madrid, en Espagne. Il acquiert une vaste expérience internationale grâce à ses bourses longue durée aux Pays-Bas, en Italie et aux États-Unis, bâtissant la majeure partie de sa carrière académique à l'Université de la Californie, à Irvine, où il découvre une nouvelle classe d'analgésiques cannabinoïdes avec un fort potentiel clinique. En 2017, il agit à titre de consultant pour les Académies nationales des sciences des États-Unis dans la préparation du rapport intitulé The health effects of cannabis and cannabinoids (Les effets du cannabis et des cannabinoïdes sur la santé). Il fonde ensuite Abagune Research pour offrir des conseils scientifiques et des solutions de R/D à l'industrie internationale du cannabis. En 2020, il assume la direction scientifique et médicale de Khiron Life Sciences en Europe.
Le royaume végétal s'est toujours révélé une source inépuisable de substances médicinales pour l'humanité. Les traités de médecine traditionnels regorgent de préparations à base de plantes pour traiter divers troubles et conditions. Cependant, avec le développement de la médecine moderne, une nouvelle discipline gagne du terrain depuis le milieu du dix-neuvième siècle : la chimie pharmaceutique. La chimie pharmaceutique se concentre sur la modification chimique des molécules principales pour améliorer leur profil thérapeutique, soit en renforçant leurs propriétés médicinales (puissance, efficacité, etc.) ou en réduisant les effets indésirables (toxicité, sélectivité, etc.). Nous pouvons donc affirmer qu'il existe un lien entre la structure d'une molécule et son activité pharmacologique (notamment, la relation structure-activité ou RSA).
L'un des premiers exemples de cette nouvelle discipline a été la découverte de l'aspirine. Depuis longtemps, les civilisations utilisent le saule blanc (Salix alba) comme remède naturel contre la douleur et la fièvre. Il figure dans les écrits des médecins de l'époque classique comme Hippocrate, Dioscoride ou Galien. En 1828, Johann Buchner, professeur de pharmacologie à l'Université de Munich, parvient à extraire le principe actif de l'écorce de saule blanc sous la forme de cristaux jaunes au goût amer qu'il nomme la salicine. Dix ans plus tard, le chimiste italien, Raffaele Piria, obtient l'acide salicylique par la transformation chimique de la salicine. En 1853, le chimiste français, Charles Frédéric Gerhardt, tente d'améliorer le goût amer et l'irritation gastrique causés par l'acide salicylique et obtient de l'acide acétylsalicylique. Cependant, ce n'est qu'en 1897 que Felix Hoffman, pharmacien aux laboratoires Bayer, parvient à réaliser une synthèse très pure de l'acide acétylsalicylique. Deux ans plus tard, la société pharmaceutique allemande commercialise le médicament avec comme nom déposé « Aspirine », il devient alors le premier médicament à entrer dans le groupe des anti-inflammatoires non stéroïdiens (AINS), groupe qui inclut également d'autres médicaments fréquemment utilisés comme l'ibuprofène, le naproxène ou l'indométacine.1
Cet exemple nous aide à illustrer la différence entre les trois types de molécules que je souhaite aborder dans cet article. Les préparations à base d'écorce de Salix alba et leur principe actif, la salicine, sont des substances naturelles, puisque leur structure n'a subi aucune modification par rapport à leur forme naturelle. L'acide salicylique et l'acide acétylsalicylique obtenus au milieu des années 1800 sont des composés semi-synthétiques, puisqu'il s'agit d'analogues basés sur une molécule naturelle dont la structure a été modifiée pour améliorer son activité. L'acide acétylsalicylique obtenu par Felix Hoffman est une molécule synthétique puisque sa préparation n'est pas produite à partir d'une substance naturelle, mais bien à partir d'autres composés chimiques plus simples. Comme l'aspirine, les autres AINS sont aussi des molécules synthétiques et, bien que leurs structures soient complètement différentes, ils partagent la même activité pharmacologique, c'est-à-dire qu'ils inhibent l'action de l'enzyme cyclo-oxygénase (COX). Or, nous pouvons établir une distinction similaire entre les cannabinoïdes naturels, synthétiques et semi-synthétiques.
Cannabinoïdes naturels
La plupart d'entre nous connaissent bien la distribution de ce film : les acteurs principaux (Δ9-THC et CBD), leurs précurseurs acides (THCA et CBDA), les acteurs de soutien qui connaissent un bon succès (CBG, CBN, Δ8-THC) et les figurants qui démontrent un potentiel prometteur (CBGA, CBC, THCV, CBDV). Lorsque l'on aborde le sujet des cannabinoïdes naturels, on évoque généralement un nombre imprécis de composés, entre 104 et 150, qui ont été identifiés dans certaines variétés de cannabis. Nous aborderons plus tard certains de ces cannabinoïdes mineurs qui ont été identifiés récemment, mais en réalité, ces composés ne semblent pas contribuer de manière significative à l'effet du cannabis et de ses dérivés, probablement en raison de leur faible abondance relative.
Notons que ce sont les cannabinoïdes naturels qui sont actuellement les molécules approuvées pour l'utilisation clinique visant à moduler le système endocannabinoïde. Leur origine naturelle rend l'obtention d'un brevet ou la protection de la propriété intellectuelle pratiquement impossible, à deux exceptions près : i) lorsqu'ils sont combinés dans des proportions précises de façon à présenter un effet différentiel, tel que le rapport 1:1 de THC et CBD dans Nabiximols, ou ii) lorsqu'ils sont formulés dans une présentation définie et immuable, comme c'est le cas avec le médicament Epidiolex, un sirop qui contient du CBD purifié qui s'est avéré efficace dans le traitement de certaines formes d'épilepsie réfractaire chez les enfants.
La production synthétique de phytocannabinoïdes s'explique également par des motifs réglementaires. Dans leur version synthétique, le THC et le CBD ne sont pas assujettis à la même loi restrictive qui rend leurs analogues naturels difficiles à utiliser, car ils proviennent d'une plante illégale ou hautement contrôlée. La récente décriminalisation du CBD naturel pour certains usages bénéficiera à la production de cannabis à faible teneur en THC par rapport aux alternatives synthétiques à base de limonène obtenues à partir d'écorces d'agrume ou d'approches biosynthétiques utilisant des microorganismes génétiquement modifiés.
Cannabinoïdes synthétiques
Malgré l'existence des versions synthétiques de THC et de CBD et par souci de simplicité, disons que les cannabinoïdes synthétiques sont des molécules qui ne sont pas liées structurellement aux cannabinoïdes naturels et qui ont été produites dans le cadre de campagnes de chimie pharmaceutique visant à obtenir des composés capables d'activer de manière sélective les récepteurs des cannabinoïdes, CB1 et CB2. Le nom de ces molécules débute habituellement par l'acronyme du chimiste responsable de sa conception, comme Alexandros Makriyannis (AM) ou John W. Huffman (JWH) qui, dans son groupe à l'Université Clemson, a produit plus de 450 cannabinoïdes synthétiques et semi-synthétiques. L'acronyme peut aussi représenter l'institution qui a mené les études et produit ces composés, comme la Hebrew University of Jerusalem (HU) où enseigne le professeur Raphael Mechoulam, créateur de certains représentants célèbres de ces familles de molécules.
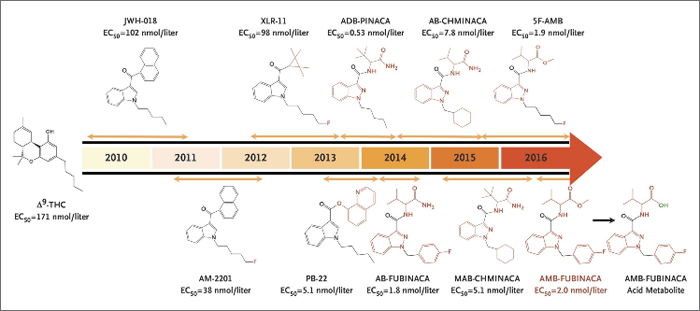
Figure 1. Les cannabinoïdes synthétiques : au service de la zombification des jeunes depuis 2010. Figure tirée d'Adams et coll., 2017.
La figure 1 représente une évolution temporelle de la manière dont ces composés sont exploités comme stupéfiants depuis des années. Ceux-ci sont produits par des organisations à mi-chemin entre Walter White et la mafia russe et commercialisés sous forme de préparations à base de plante sur lesquelles on pulvérise des cannabinoïdes synthétiques. Chaque fois que les autorités sanitaires en identifient ou en interdisent un, un nouveau produit prend le relais sous les noms de « Spice » ou « K2 ». Il s'agit généralement d'agonistes très puissants du récepteur CB1, qui ont également la caractéristique d'être des agonistes complets (le THC est un agoniste partiel) et qui peuvent notamment exacerber les effets indésirables associés à l'activation centrale du CB1, ce qui donne lieu à des épisodes grotesques comme la fameuse « attaque de zombies » qui est survenue à New York à l'été 2016.2
Cannabinoïdes semi-synthétiques
La principale différence entre le cannabinoïde synthétique et le semi-synthétique est que ce dernier conserve la structure chimique du THC, mais avec quelques petites modifications chimiques pour améliorer ou raffiner son profil pharmacologique. Comme les composés semi-synthétiques se basent sur une molécule dont l'activité est déjà connue, ils ont l'avantage de pouvoir rationaliser l'effet de la ou des modifications chimiques alors que l'étude de RSA progresse. La figure 2 illustre certains des groupes chimiques (aussi appelés « résidus ») les plus pertinents à l'activité du THC ainsi que les modifications qui influencent leur profil pharmacologique.3 Examinons trois de ces positions : C2, C3 et C9.
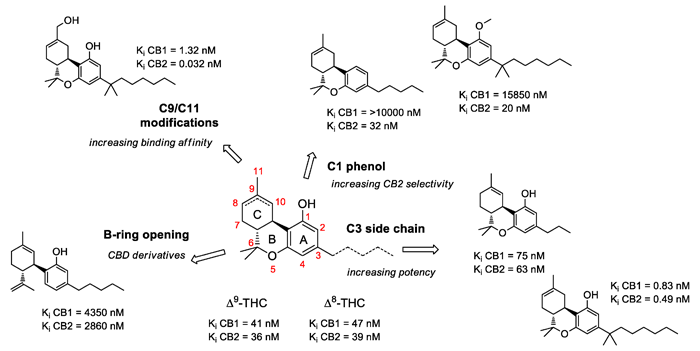
Figure 2. Modifications chimiques de la structure originale de Δ9-tétrahydrocannabinol. Figure tirée de Prandi et coll., 2018.
C3, chaîne latérale : l'un des groupes chimiques présentant la plus grande variabilité est la chaîne aliphatique qui correspond au zigzag suspendu au carbone 3 et qui, dans le cas du THC et du CBD, se compose de cinq pointes représentant cinq atomes de carbone, d'où son nom, pentyle qui vient du grec « penta » (cinq). Parmi les cannabinoïdes naturels, il y a le tétrahydrocannabivarine (THCV) et le cannabidivarine (CBDV), des analogues du THC et du CBD, mais avec une chaîne raccourcie de trois carbones (figure 2). En 2020, un groupe italien dirigé par Giuseppe Cannazza a identifié quatre nouveaux composés, des analogues structurels du THC et du CBD, mais avec des chaînes aliphatiques de six et sept carbones respectivement appelés tétrahydrocannabihexol (THCH), cannabidihexol (CBDH), tétrahydrocannabiphorol (THCP) et cannabidiphorol (CBDP).4 Bien que la nouvelle d'un nouveau cannabinoïde beaucoup plus puissant que le THC ait raisonné dans divers médias spécialisés, cette découverte n'était pas surprenante aux yeux de ceux qui connaissent les études de relation structure-activité menées à ce jour avec le THC, dans lesquelles la substitution de diméthyl heptyle allait produire les plus puissants analogues (figure 2). Apparemment, avec les chaînes aliphatiques et les récepteurs des cannabinoïdes, la grosseur compte vraiment.
C9, le carbone actif : la position C9 dans la structure du THC présente un groupement méthyle (C11 dans la figure). Lorsque notre corps métabolise le THC après l'avoir consommé, spécialement par voie orale, le foie utilise une partie de ses enzymes CYP 450 pour transformer ce groupement méthyle (-CH3) en groupe hydroxyle (-CH2OH) donnant lieu à 11-OH-THC, puis en groupe carboxyle (-COOH) découlant de 11-COOH-THC, un métabolite décelé dans l'urine qui entraîne le résultat positif d'un test de dépistage. Du point de vue de la chimie médicale, les résidus hydroxyle et carboxyle sont bien plus intéressants que le groupement méthyle, car ils contiennent des atomes d'oxygène et d'hydrogène, qui donnent normalement lieu à un genre d'interactions intermoléculaires appelées « liaisons hydrogène ». Les liaisons hydrogène sont essentielles dans la nature et sont responsables de nombreux phénomènes naturels, tels que la cristallisation de l'eau dans la glace ou le repliement de l'ADN. En fait, ce n'est pas un hasard si les deux dérivés semi-synthétiques du THC qui ont atteint un niveau de développement clinique plus poussé — le nabilone et l'acide ajulémique (également connu sous le nom de HU-239) — ont un résidu diméthyl heptyle dans leur chaîne aliphatique et un groupement polaire dans leur carbone C9, une cétone et un acide carboxylique, respectivement.5
C2, le carbone des acides. Comme nous l'avons mentionné au début de cet article, les cannabinoïdes naturels les plus abondants sont le THCA et CBDA, qui sont les précurseurs acides du THC et du CBD, mais aussi la forme de la molécule produite naturellement par la plante. Ils se distinguent de la forme neutre par un groupe carboxyle à la position C2, qui se perd dans le processus de « décarboxylation » pendant la combustion, la cuisson ou l'extraction des fleurs de cannabis. Malgré qu'elles soient des molécules très intéressantes d'un point de vue pharmacologique, leur tendance naturelle à perdre ce groupe carboxyle les rend trop instables pour respecter les normes de qualité qui régissent les développements pharmaceutiques. Dans une tentative de stabiliser ce groupe carboxyle, le professeur Raphael Mechoulam a proposé un nouveau cannabinoïde semi-synthétique, HU-580, qui a déjà été annoncé comme étant sa dernière découverte (et c'est possible, puisque Raphi vient d'avoir 90 ans) et promet d'être plus puissant que le THC et le CBD.6 Voyons de quoi il s'agit.
HU-580 conserve la structure de CBDA, mais au lieu du groupe carboxyle (-COOH) en position C2, il présente un ester méthylique (-COOCH3). HU-580 a été testé avec un certain succès sur des modèles animaux par des collaborateurs réguliers du prof. Mechoulam, comme les légendes de la recherche sur les cannabinoïdes, Roger Pertwee et Linda Parker, pour traiter la nausée et l'anxiété.7 D'un point de vue pharmacologique, il semblerait que HU-580 soit plus similaire au CBD qu'au CBDA, qui présente des activités supplémentaires telles que l'inhibition de l'enzyme COX, entre autres, de la même manière que le font l'aspirine et d'autres AINS. Et, du point de vue de son activité pharmacologique, comparer un groupe carboxyle à un ester méthylique revient à comparer un couteau à beurre avec une cuillère à café : aucun des deux ne pique ou ne coupe. Précisément, c'est qu'il a perdu sa capacité à créer des liaisons hydrogène. C'est comme avoir une barre de plutonium, vibrante, réactive, instable et, pour la stabiliser, on l'ensevelissait sous un chargement de béton. Le résultat sera certainement plus stable, mais il ne peut plus être utilisé pour générer de l'énergie, détruire la planète ou permettre un retour vers le futur. Afin de stabiliser le CBDA, il faut le tuer.
J'espère que je me trompe et que HU-580 peut démontrer une certaine valeur ajoutée à la pharmacologie du CBD. Sinon, sa carrière sera courte. Le nabilone et l'acide ajulémique ont eu des chances mitigées dans leur développement clinique, et leur acceptation et leur utilisation par la communauté médicale sont minimes par rapport à celles du THC. Malgré les avantages théoriques possibles des cannabinoïdes semi-synthétiques d'un point de vue pharmaceutique, juridique et de propriété intellectuelle, la vérité est qu'ils n'ont pas encore réussi à déloger les cannabinoïdes naturels qui continuent d'être les meilleurs outils dont nous disposons en clinique pour moduler le système endocannabinoïde.
1. A history of aspirin - The Pharmaceutical Journal. https://pharmaceutical-journal.com/article/infographics/a-history-of-aspirin.
2. Adams, A. J. et al. "Zombie" Outbreak Caused by the Synthetic Cannabinoid AMB-FUBINACA in New York. N. Engl. J. Med. 376, 235–242 (2017).
3. Prandi, C., Blangetti, M., Namdar, D. & Koltai, H. Structure-activity relationship of cannabis derived compounds for the treatment of neuronal activity-related diseases. Molecules vol. 23 1526 (2018).
4. Linciano, P. et al. Identification of a new cannabidiol n-hexyl homolog in a medicinal cannabis variety with an antinociceptive activity in mice: cannabidihexol. Sci. Rep. 10, 1–11 (2020).
5. Burstein, S. H. & Zurier, R. B. Cannabinoids, endocannabinoids, and related analogs in inflammation. AAPS Journal vol. 11 109–119 (2009).
6. More Potent Than CBD, THC: Dr. Raphael Mechoulam Explains His Latest Discovery. https://www.forbes.com/sites/javierhasse/2020/07/12/dr-mechoulam/?sh=38df958b6a45.
7. Roger Pertwee, C. G. et al. Cannabidiolic acid methyl ester, a stable synthetic analogue of cannabidiolic acid, can produce 5-HT 1A receptor-mediated suppression of nausea and anxiety in rats. Br. J. Pharmacol. 175, 100 (2018).