Por Guillermo Moreno-Sanz

El Dr. Moreno-Sanz es autor de más de 30 artículos científicos y 3 patentes que describen el papel del sistema endocannabinoide en la percepción del dolor. Licenciado en Bioquímica y Química Orgánica por la Universidad de Zaragoza, obtuvo su doctorado en Neurociencias por la Universidad Complutense de Madrid en España. Adquirió una amplia experiencia internacional con becas de larga duración en los Países Bajos, Italia y los Estados Unidos, desarrollando la mayor parte de su carrera académica en la Universidad de California, Irvine, donde descubre una nueva clase de analgésicos cannabinoides de gran interés clínico. En 2017 actúa como consultor para las Academias Nacionales de Ciencias de Estados Unidos en la elaboración del informe "Los efectos sobre la salud del cannabis y los cannabinoides" y posteriormente funda Abagune Research con el fin de ofrecer asesoramiento científico y soluciones de I+D a la industria internacional del cannabis. En 2020 asume la dirección científica y médica de Khiron Life Sciences en Europa.
La mayoría de los pacientes que recurren a un tratamiento con cannabis o sus derivados lo hacen para paliar síntomas asociados al dolor crónico. Esta es una constante que se repite en todos los estudios realizados en aquellos paises donde existen programas de acceso a cannabis medicinal, solo alterada recientemente por el creciente número de pacientes que usan cannabis para paliar trastornos relacionados con la ansiedad y el estrés.
Por este motivo, resulta tan sangrante para aquellos que reclaman la regulación del uso terapéutico del cannabis el hecho de que asociaciones médicas lideres de opinión como la Asociación Internacional para el Estudio del Dolor (IASP) desaconseje, basándose en la evidencia existente (o inexistente), el uso de cannabinoides para el tratamiento del dolor. Este debate sobre la existencia o inexistencia de suficiente evidencia científica para recomendar el uso terapéutico del cannabis ha calado en la subcomisión del congreso que actualmente prepara una propuesta para regular el uso medicinal del cannabis en España, la cual, alejándose de su mandato de "analizar experiencias de regulación del cannabis para uso medicinal", parece adentrarse en aguas turbulentas en las que uno puede fácilmente perderse. (1)
Pero, ¿a qué nos referimos cuando hablamos de medicina basada en la evidencia?
Cuando un médico toma una decisión terapéutica, generalmente se basa en su propia experiencia clínica, unida a los mejores datos objetivos disponibles, y siempre teniendo en cuenta las preferencias de los pacientes. Estos datos científicos en los que apoyar una intervención terapéutica es lo que se conoce como evidencia médica. Aunque suene lógico y afianzado, la medicina basada en la evidencia es relativamente joven, ya que se desarrolló en los años 70 con el auge de los ensayos clínicos para la aprobación y comercialización de medicamentos. Uno de los pioneros de esta medicina basada en la evidencia fue el epidemiólogo clínico británico Archie Cochrane, quien definió tres conceptos relacionados con la toma de decisiones sobre un tratamiento: La eficacia, la efectividad y la eficiencia. La eficacia determina si un tratamiento hace más bien que mal en condiciones controladas, como las de un ensayo clínico (¿funciona?). La efectividad evalúa si un tratamiento hace más bien que mal cuando se administra en las condiciones habituales de la práctica sanitaria (¿funciona en el mundo real?). La eficiencia mide el efecto de una intervención en relación con los recursos que requiere (¿merece la pena?).(2) Sin embargo, no fue hasta principios de los 90 cuando se inició un cambio en el modelo de la enseñanza y el ejercicio de la medicina, se formulaba el ideario del movimiento de la Medicina basada en la evidencia, y se esculpían en piedra las metodologías empleadas para determinar la calidad de la evidencia científica. (3) Así, en 1993, se funda Cochrane, la organización sin ánimo de lucro que a través del trabajo de investigadores voluntarios de todo el mundo revisa, rigurosa y sistemáticamente, las intervenciones en salud para facilitar la toma de decisiones que han de asumir los profesionales de la salud, los pacientes, y los responsables de políticas de salud de acuerdo con los principios de la medicina basada en la evidencia.
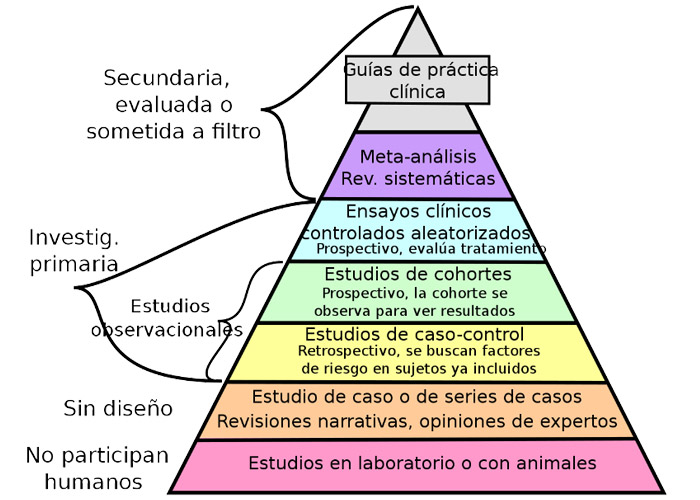
Pie de figura: Pirámide de la calidad de la evidencia científica (basada en la referencia 3).
¡Evidencia científica de la buena!
Como se puede apreciar en la "pirámide de la calidad de la evidencia científica" (ver figura basada en (3)), los datos considerados de mayor calidad provienen de los resultados de "estudios experimentales" como son los ensayos clínicos aleatorizados (ECAs), los metaanálisis o las revisiones sistemáticas. En un segundo plano quedan los datos que provienen de "estudios observacionales", como son los estudios de cohortes o los casos clínicos, que pueden ser muy variados en su diseño y su tipología. Y ya al fondo de la pirámide queda la evidencia clínica de muy baja calidad para informar una opción terapéutica como son las revisiones narrativas, las opiniones de expertos y los ensayos en animales.
Los ECAs son investigaciones realizadas en humanos en fases progresivas, primero en voluntarios sanos y después en pacientes, cuyo objetivo es el de determinar la eficacia (¿funciona?) de un fármaco o dispositivo médico para una indicación concreta. Estos estudios forman parte del proceso de registro y obtención de la autorización necesaria para comercializar dicho producto para dicha indicación. Este proceso es extremadamente costoso, tanto en tiempo como en recursos económicos, y suele utilizarse para nuevos fármacos protegidos por propiedad intelectual que permita al promotor recuperar la inversión a través de las ventas del producto. Este es uno de los principales motivos por los que los derivados de cannabis, que son difícilmente patentables y se comercializan como fórmulas magistrales, no resulten atractivos para desarrollar medicamentos por la vía farmacéutica tradicional. Los ECAs también son imprescindibles para establecer la seguridad de un nuevo medicamento. En este sentido cabe destacar los ensayos de "primera vez en humanos", en los que fármacos cuya toxicidad se ha descartado en células y en animales, se administran por primera vez a humanos sanos. Con más de 5000 años de uso en humanos, el cannabis presenta un perfil farmacológico muy seguro, con unos efectos segundarios leves y mitigables. Los metaanálisis son herramientas estadísticas que permiten combinar resultados de distintos estudios para analizar las mismas variables y que, por tanto, pueden aportar más información o tener un alcance mayor que cada uno de los estudios clínicos individuales de los que se obtuvieron los datos. Por último, las revisiones sistemáticas, hacen un resumen estructurado a través de una metodología rigurosa de la evidencia existente y publicada en distintos formatos.
Por otro lado, los estudios observacionales son aquellos en los que los investigadores no interfieren con lo que sucede en la práctica clínica habitual. Es decir, se limitan a observar y recoger información, pero no pueden controlar ninguna variable, determinar las dosis o tiempos de administración, aleatorizar pacientes ni asignarle a un grupo placebo. Sin embargo, este tipo de estudios han ganado relevancia en los últimos años gracias a su capacidad para recabar evidencia o datos del mundo real, frente a los estrictos criterios de inclusión y exclusión de los ECAs, que provocan a menudo que los participantes del estudio no sean representativos de poblaciones clínicas más amplias. Por tanto, cada vez más se considera que los estudios del mundo real pueden aportar información complementaria a la obtenida en los ECAs, recogida a través de historias clínicas electrónicas por periodos de tiempo largos, acerca de la seguridad a largo plazo y efectividad de un tratamiento (¿funciona en la práctica?) en poblaciones amplias y heterogéneas, así como patrones de prescripción o implicaciones médicas y económicas de su uso.(4)
¿Y qué pasa con el cannabis medicinal?
Como hemos visto, la evidencia considerada de alta calidad según las tablas de la ley de la medicina basada en la evidencia proviene de los ECAs y sus metaanálisis. Hasta la fecha se han publicado unos sesenta ECAs investigando el uso de cannabinoides en el tratamiento del dolor, con una considerable heterogeneidad en cuanto al tamaño de la población, la indicación, la presentación (desde flores de cannabis para inhalar hasta THC sintético oral), las dosis, las proporciones de THC y CBD, la vía de administración, la duración del tratamiento (de pocas horas a varios meses) y los desenlaces medidos, por lo que, como cabría esperar, los resultados obtenidos son contradictorios. En un intento por consolidar estos resultados, empezaron a surgir revisiones sistemáticas y metaanálisis de los mismos. Entre 2010 y 2019, se publicaron 57 estudios de este tipo que no han hecho sino encarnizar el debate debido a su amplio abanico de conclusiones que van desde los que encuentran evidencia clara de eficacia hasta los que afirman justamente lo contrario. Y es que hay que tener en cuenta que los ECAs destinados a la comercialización de los dos medicamentos autorizados basados en cannabis o cannabinoides, Sativex y Epidiolex, no buscaban caracterizar estos productos en poblaciones de dolor crónico, sino de esclerosis múltiple y de epilepsia pediátrica refractaria, respectivamente. Al mismo tiempo, aquellos países en los que el acceso a cannabis para uso terapéutico está regulado comienzan a acumular evidencia del mundo real que sugiere que los pacientes con dolor crónico ven mejorada su calidad de vida notablemente al incluir preparados de cannabis medicinal en su régimen de tratamiento. Basándose en estos resultados y en contraste con la declaración de la IASP, la Federación Europea del Dolor recomienda considerar el cannabis medicinal como una terapia de tercera línea para el dolor neuropático crónico mientras que, para el resto de los casos de dolor crónico, el uso de los derivados de cannabis debe considerarse como un ensayo terapéutico individual.(1) Esto quiere decir que, si todos los tratamientos aprobados han fracasado, y tras un análisis cuidadoso y una evaluación multidisciplinar, un médico debe de tener la capacidad de recetar cannabis medicinal a su paciente si considera que este pudiera beneficiarse del tratamiento. Parece que, poco a poco, y gracias a la acumulación de evidencia del mundo real obtenida a través de los miles de pacientes que ya se benefician de un tratamiento con derivados de cannabis, las preguntas de Cochrane van obteniendo una respuesta. Pronto la cuestión no será si el cannabis medicinal es efectivo (que no eficaz) sino si es eficiente. Porque, para cerrar el círculo del acceso a un tratamiento medicinal, y evitar las amenazas del mercado negro o de la regulación recreativa, será necesario que el coste del tratamiento esté cubierto o subvencionado para aquellos pacientes que lo necesiten. Como debe ser.
Referencias:
1. Eisenberg E, Morlion B, Brill S, Häuser W. Medicinal cannabis for chronic pain: The bermuda triangle of low-quality studies, countless meta-analyses and conflicting recommendations. Eur J Pain. 2022 Apr 6;
2. Haynes B. Can it work? Does it work? Is it worth it? The testing of healthcareinterventions is evolving. BMJ. 1999 Sep 11;319(7211):652–3.
3. Evidence-based medicine. A new approach to teaching the practice of medicine. JAMA. 1992 Nov 4;268(17):2420–5.
4. Blonde L, Khunti K, Harris SB, Meizinger C, Skolnik NS. Interpretation and Impact of Real-World Clinical Data for the Practicing Clinician. Adv Ther. 2018 Nov 1;35(11):1763–74.