Por Guillermo Moreno-Sanz

El Dr. Moreno-Sanz es autor de más de 30 artículos científicos y 3 patentes que describen el papel del sistema endocannabinoide en la percepción del dolor. Licenciado en Bioquímica y Química Orgánica por la Universidad de Zaragoza, obtuvo su doctorado en Neurociencias por la Universidad Complutense de Madrid en España. Adquirió una amplia experiencia internacional con becas de larga duración en los Países Bajos, Italia y los Estados Unidos, desarrollando la mayor parte de su carrera académica en la Universidad de California, Irvine, donde descubre una nueva clase de analgésicos cannabinoides de gran interés clínico. En 2017 actúa como consultor para las Academias Nacionales de Ciencias de Estados Unidos en la elaboración del informe "Los efectos sobre la salud del cannabis y los cannabinoides" y posteriormente funda Abagune Research con el fin de ofrecer asesoramiento científico y soluciones de I+D a la industria internacional del cannabis. En 2020 asume la dirección científica y médica de Khiron Life Sciences en Europa.
El reino vegetal ha sido desde siempre una fuente inagotable de recursos medicinales para el ser humano. Los tratados de medicina tradicionales están repletos de preparaciones a base de plantas para distintos trastornos y afecciones. Sin embargo, con el desarrollo de la medicina moderna, una nueva disciplina viene abriéndose paso desde mediados del siglo XIX: la química médica. La química médica se dedica a la modificación química de moléculas para mejorar su perfil terapéutico, ya sea reforzando sus propiedades medicinales (potencia, eficacia, etc.) o reduciendo sus efectos adversos (toxicidad, selectividad, etc.). Podemos afirmar, por lo tanto, que existe una relación entre la estructura de una molécula y su actividad farmacológica (relación estructura-actividad o, en inglés, SAR).
Uno de los primeros ejemplos de esta nueva disciplina fue el descubrimiento de la aspirina. El sauce blanco (Salix alba) ha sido utilizado por distintas civilizaciones con fines medicinales, apareciendo en los textos de médicos clásicos como Hipócrates, Dioscórides o Galeno como un alivio natural para los dolores y la fiebre. El principio activo de la corteza del sauce fue aislado en 1828 por Johann Buchner, profesor de farmacología en la Universidad de Munich en forma de unos cristales amarillos y amargos que llamó salicina. Diez años más tarde, el químico italiano Raffaele Piria obtenía el ácido salicílico a través la transformación química de la salicina. En 1853, el químico francés Charles Frédéric Gerhardt obtuvo el acido acetilsalicílico al tratar de mejorar el sabor amargo y la irritación gástrica causada por el acido salicílico. Sin embargo, no sería hasta 1897 cuando Felix Hoffmann, farmacéutico de los laboratorios Bayer, lograba la síntesis del ácido acetilsalicílico de gran pureza. Dos años más tarde, la farmacéutica alemana iniciaba su venta bajo el nombre comercial "Aspirina", convirtiéndose en el primer fármaco del grupo de los antiinflamatorios no esteroideos (AINEs) al que pertenecen otros medicamentos, como el ibuprofeno, el naproxeno o la indometacina.1
Este ejemplo nos sirve para ilustrar las diferencias entre los tres tipos de moléculas de los que quería hablar en este artículo. Los preparados de corteza de Salix alba y su principio activo, la salicina, son sustancias naturales, ya que su estructura no ha sufrido ninguna modificación con respecto a la forma en la que se encuentran en la naturaleza. El ácido salicílico y el ácido acetilsalicílico obtenidos a mediados del 1800 son compuestos semi-sintéticos, por tratarse de análogos que parten de una molécula natural a la que se le ha modificado su estructura en un intento de mejorar su actividad. El acido acetilsalicílico obtenido por Felix Hoffman es una molécula sintética, ya que su preparación no parte de una sustancia natural, sino de otros compuestos químicos mas simples. Como la aspirina, el resto de AINEs son también moléculas sintéticas y, a pesar de que sus estructuras son completamente diferentes, comparten su actividad farmacológica, esto es, todos inhiben la enzima ciclooxigenasa (COX). De manera similar, podemos establecer una distinción entre cannabinoides naturales, sintéticos y semisintéticos.
Cannabinoides naturales
A estas alturas, casi todos conocemos a los sospechosos habituales: los protas (Δ9-THC y CBD), sus precursores ácidos (THCA y CBDA), los secundarios que vienen pisando fuerte (CBG, CBN, Δ8-THC) y los extras con potencial prometedor (CBGA, CBC, THCV, CBDV). Es habitual que cuando se empieza a hablar de cannabinoides naturales se cite un número difuso, entre 104 y 150, de compuestos de esta familia que han sido identificados en alguna variedad de cannabis. Más adelante hablaremos de algunos de estos cannabinoides minoritarios que han sido caracterizados recientemente, pero lo cierto es que, probablemente debido a su escasa abundancia relativa, estos compuestos no parecen contribuir de manera significativa al efecto del cannabis y sus derivados.
Cabe resaltar que el hecho de que los cannabinoides naturales son actualmente las únicas moléculas capaces de modular el sistema endocannabinoide aprobadas para su uso clínico. Su carácter natural hace que sean imposibles de patentar o de proteger intelectualmente salvo por dos excepciones: i) que se combinen en una proporción particular que presente un efecto diferencial, como la proporción 1:1 de THC y CBD en el medicamento Sativex, o ii) que se formulen en una presentación definida e inmutable, como es el caso del medicamento Epidiolex, un jarabe que contiene una concentración determinada de CBD purificado.
Existen también motivos regulatorios por los que los fitocannabinoides se han producido de manera sintética. En su versión sintética, tanto el THC y el CBD no estaban sujetos a la misma legislación restrictiva que dificultaba la utilización de sus análogos naturales por el hecho de provenir de una planta prohibida o altamente fiscalizada. La reciente despenalización del CBD natural beneficiará su producción a partir de cannabis de bajo THC frente a alternativas sintéticas que partían del limoneno obtenido de cortezas de cítricos o biosintéticas, que utilizaban microorganismos modificados genéticamente.
Cannabinoides sintéticos
Para no extendernos innecesariamente, podemos decir que los cannabinoides sintéticos son aquellas moléculas que no guardan relación estructural con los cannabinoides naturales, y que se han producido en campañas de química médica para obtener compuestos capaces de activar de manera selectiva los receptores cannabinoides, tanto el CB1 como el CB2. Los nombres de estas moléculas suelen comenzar con un acrónimo del químico que las diseñó como Alexandros Makriyannis (AM) o John W. Huffman (JWH) quien, en su grupo de la universidad de Clemson, produjo más de 450 cannabinoides sintéticos y semisintéticos. El acrónimo también puede pertenecer a la institución en la que se llevaron a cabo los estudios que produjeron estos compuestos como es el caso de la Universidad Hebrea de Jerusalem (HU) donde trabaja el profesor Raphael Mechoulam, artífice de algunos famosos representantes de estas familias de moléculas.
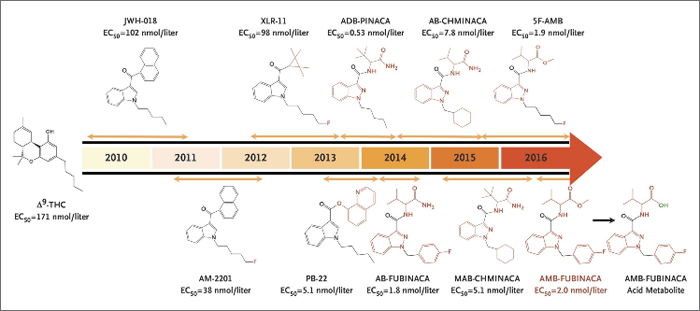
Figura 1. Cannabinoides sintéticos: Convirtiendo a la juventud en zombies desde 2010. Imagen tomada de Adams et al., 2017.
La figura 1 representa una evolución temporal de cómo estos compuestos han sido adoptados para su explotación como drogas de abuso, siendo producidos por organizaciones a caballo entre Walter White y la mafia rusa, y comercializados en forma de preparados herbales sobre los que se pulverizan estos cannabinoides sintéticos. Cada vez que las autoridades sanitarias identifican y prohíben uno, otro nuevo ocupa su lugar en productos conocidos como "Spice" o "K2". Se trata en general de agonistas muy potentes del receptor CB1, que tienen además la característica de ser agonistas totales (el THC es un agonista parcial) que pueden por tanto exacerbar los efectos adversos asociados a la activación central del CB1, dando lugar a esperpentos como el "ataque zombi" ocurrido en Nueva York en el verano de 2016.2
Cannabinoides semisintéticos
La diferencia fundamental entre los cannabinoides sintéticos y los semisintéticos es que estos últimos mantienen la estructura química del THC, sobre la cual se producen pequeñas modificaciones químicas con el fin de mejorar o afinar su perfil farmacológico. La ventaja que presentan los semisintéticos es que se parte de una molécula de la cual ya se conoce su actividad y que es posible racionalizar cuál será el efecto de la modificación o modificaciones químicas conforme se avanza en el estudio de la SAR. La figura 2 recoge algunos de los grupos (también llamados "residuos") químicos mas relevantes para la actividad del THC y como la modificación de los mismo puede afectar a su perfil farmacológico.3 Nos centraremos en tres de estas posiciones: C2, C3 y C9.
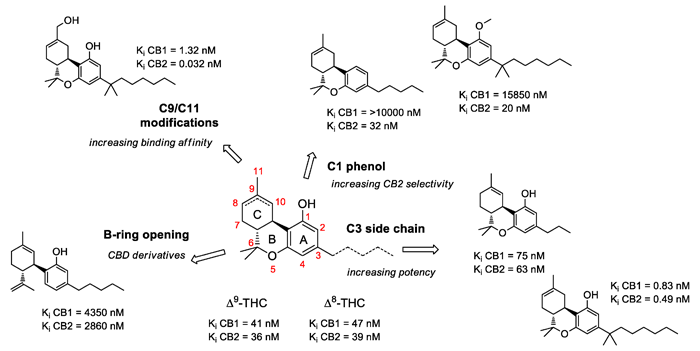
Figura 2. Modificaciones químicas de la estructura original del Δ9-tetrahidrocannabinol. Imagen tomada de Prandi et al., 2018.
C3, cadena lateral: Uno de los grupos químicos que presenta mayor variabilidad es la cadena alifática, que es esa línea en forma de zigzag que cuelga del carbono 3 y que, en el caso del THC y el CBD, tiene cinco puntas, lo que representa cinco átomos de carbono. De ahí su nombre, pentilo, que proviene del griego "penta". Entre los cannabinoides naturales encontramos la tetrahidrocannabivarina (THCV) y la cannabidivarina (CBDV), que son análogos del THC y el CBD, pero con una cadena mas corta, de tres carbonos (figura 2). En 2020, un grupo italiano dirigido por Giuseppe Cannazza identificó cuatro nuevos compuestos, análogos estructurales del THC y el CBD, pero con cadenas alifáticas de seis y siete carbonos respectivamente, denominados tetrahidrocannabihexol (THCH), cannabidihexol (CBDH), tetrahidrocannabiphorol (THCP) y cannabidiphorol (CBDP).4 Aunque la noticia de un nuevo cannabinoide mucho mas potente que el THC se hizo eco en distintos medios especializados, no resultaba nada sorprendente para aquellos familiarizados con los estudios de relación estructura-actividad realizados con THC hasta la fecha, en los que el dimetilheptilo había resultado ser el análogo más potente (figura 2). Y es que, al parecer, cuando hablamos de cadenas alifáticas y receptores cannabinoides, el tamaño sí que importa.
C9, el carbono activo: La posición C9 en la estructura del THC presenta un grupo metilo (C11 en la figura). Cuando nuestro organismo metaboliza el THC después de consumirlo, sobre todo por vía oral, el hígado utiliza alguna de sus enzimas CYP 450 para transformar este grupo metilo (-CH3) en un grupo hidroxilo (-CH2OH) dando lugar al 11-OH-THC y, posteriormente, en un grupo carboxilo (-COOH) originando el 11-COOH-THC que es el metabolito que se encuentra en la orina y que hace que des positivo en una prueba de drogas. Desde el punto de vista de la química médica, los grupos hidroxilo y carboxilo son mucho mas interesantes que el grupo metilo, ya que contienen átomos de oxigeno e hidrógeno, que dan lugar normalmente a un tipo de interacción entre moléculas llamados "puentes de hidrógeno". Los puentes de hidrógeno son fundamentales para las interacciones entre unas moléculas y otras y son responsables de una gran cantidad de reacciones naturales, como la cristalización del agua en hielo o el plegamiento del ADN. De hecho, no es casualidad que los dos derivados semisintéticos de THC que han alcanzado un mayor desarrollo clínico, la nabilona y el ácido ajulémico (también conocido como HU-239), presenten un residuo dimetilheptilo en su cadena alifática y un grupo polar en su carbono C9, una cetona y un ácido carboxílico respectivamente.5
C2, el carbono de los ácidos. Como mencionábamos al principio, los cannabinoides naturales más abundantes son el THCA y el CBDA, que son los precursores ácidos del THC y el CBD, y la forma natural en la que la planta produce estas moléculas. Se diferencian por poseer un grupo carboxilo en la posición C2, que se perderá en el proceso de "descarboxilación" durante la combustión, el horneado o la extracción de las flores de cannabis. A pesar de ser moléculas muy interesantes desde el punto de vista farmacológico, su tendencia natural a perder este grupo carboxilo las hace demasiado inestables para cumplir con los estándares de calidad que rigen los desarrollos farmacéuticos. Para tratar de estabilizar este grupo carboxilo, el profesor Raphael Mechoulam ha propuesto un nuevo semisintético, el HU-580, que ya ha sido publicitado como su último descubrimiento (y puede serlo, ya que Raphi acaba de cumplir 90 años) y promete ser más potente que el THC y el CBD.6 Veamos en qué consiste:
El HU-580 mantiene la estructura del CBDA, pero en lugar del grupo carboxilo (-COOH) en la posición C2, presente un metil ester (-COOCH3). Ha sido probado con cierto éxito por los colaboradores habituales de Mechoulam, Roger Pertwee y Linda Parker, en modelos animales de nausea y ansiedad.7 Desde el punto de vista farmacológico, parecería que el HU-580 se asemeja más al CBD que al CBDA, el cual presenta actividades adicionales como, entre otras, ser un inhibidor de la enzima COX, como lo son la aspirina y otros AINEs. Y es que, desde el punto de vista de actividad farmacológica, comparar un grupo carboxilo con un metil ester es como comparar un cuchillo de sierra con una cucharilla de café: ni pincha ni corta. Precisamente porque no tiene la posibilidad de crear puentes de hidrógeno. Es como tener un bidón de plutonio, vibrante, reactivo, inestable y, para estabilizarlo, volcarle encima un camión de hormigón. El resultado será definitivamente más estable, pero ya no podrá utilizarse para generar energía, destruir el planeta o viajar en el tiempo. Para estabilizar el CBDA, hubo que matarlo.
Espero equivocarme y que el HU-580 pueda demostrar algún valor añadido a la farmacología del CBD. De lo contrario, su recorrido será breve. Tanto la nabilona como el ácido ajulémico han corrido una suerte dispar en su desarrollo clínico y su aceptación y utilización por parte de la comunidad médica es mínima comparada con la del THC. A pesar de los posibles beneficios teóricos desde el punto de vista farmacéutico, legal y de propiedad intelectual que presentan los semisintéticos, lo cierto es que aún no han conseguido desbancar a los cannabinoides naturales que continúan siendo las mejores herramientas de las que disponemos en la práctica clínica.
1. A history of aspirin - The Pharmaceutical Journal. https://pharmaceutical-journal.com/article/infographics/a-history-of-aspirin.
2. Adams, A. J. et al. "Zombie" Outbreak Caused by the Synthetic Cannabinoid AMB-FUBINACA in New York. N. Engl. J. Med. 376, 235–242 (2017).
3. Prandi, C., Blangetti, M., Namdar, D. & Koltai, H. Structure-activity relationship of cannabis derived compounds for the treatment of neuronal activity-related diseases. Molecules vol. 23 1526 (2018).
4. Linciano, P. et al. Identification of a new cannabidiol n-hexyl homolog in a medicinal cannabis variety with an antinociceptive activity in mice: cannabidihexol. Sci. Rep. 10, 1–11 (2020).
5. Burstein, S. H. & Zurier, R. B. Cannabinoids, endocannabinoids, and related analogs in inflammation. AAPS Journal vol. 11 109–119 (2009).
6. More Potent Than CBD, THC: Dr. Raphael Mechoulam Explains His Latest Discovery. https://www.forbes.com/sites/javierhasse/2020/07/12/dr-mechoulam/?sh=38df958b6a45.
7. Roger Pertwee, C. G. et al. Cannabidiolic acid methyl ester, a stable synthetic analogue of cannabidiolic acid, can produce 5-HT 1A receptor-mediated suppression of nausea and anxiety in rats. Br. J. Pharmacol. 175, 100 (2018).