Por Guillermo Moreno-Sanz

El Dr. Moreno-Sanz es autor de más de 30 artículos científicos y 3 patentes que describen el papel del sistema endocannabinoide en la percepción del dolor. Licenciado en Bioquímica y Química Orgánica por la Universidad de Zaragoza, obtuvo su doctorado en Neurociencias por la Universidad Complutense de Madrid en España. Adquirió una amplia experiencia internacional con becas de larga duración en los Países Bajos, Italia y los Estados Unidos, desarrollando la mayor parte de su carrera académica en la Universidad de California, Irvine, donde descubre una nueva clase de analgésicos cannabinoides de gran interés clínico. En 2017 actúa como consultor para las Academias Nacionales de Ciencias de Estados Unidos en la elaboración del informe "Los efectos sobre la salud del cannabis y los cannabinoides" y posteriormente funda Abagune Research con el fin de ofrecer asesoramiento científico y soluciones de I+D a la industria internacional del cannabis. En 2020 asume la dirección científica y médica de Khiron Life Sciences en Europa.
El pasado mes de marzo, la prestigiosa revista científica Nature publicaba los resultados de una investigación en la que científicos de la universidad de California Berkeley describían la producción de fitocannabinoides, como el THC y el CBD, en cepas de levadura modificadas genéticamente. Este avance técnico abre la puerta a la producción de cannabinoides purificados para la industria cosmética, farmacéutica y recreativa sin la necesidad de cultivar y extraer la planta de cannabis. Esta opción está siendo investigada por distintas empresas y podría tratarse de un factor desequilibrante en la futura industria del cannabis. En este artículo intentaremos desentrañar en qué consiste esta técnica y cuáles son sus ventajas y sus limitaciones.
¿En qué consiste la biosíntesis?
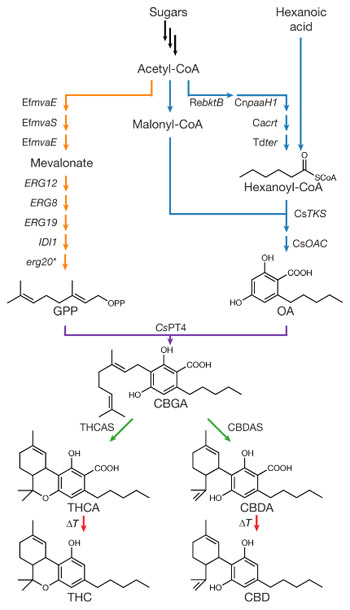
Figura 1. Rutas de síntesis de THCA y CBDA incluidas
genéticamente en levaduras dotan estos
microorganismos con la capacidad de producir
cannabinoides (from Luo et al., 2019).
A diferencia de la síntesis química, que se realiza a través de reacciones controladas en el interior de un matraz o un reactor, la biosíntesis es la formación de moléculas en el interior de un organismo vivo. Normalmente, este proceso lo llevan a cabo unas proteínas especializadas llamadas enzimas.
Cada enzima facilita la conversión de una o varias moléculas precursoras que reaccionan entre sí llamadas "substratos", en una o varias sustancias nuevas llamadas "productos de síntesis" o "productos de reacción". Es común que las enzimas reciban el nombre de su substrato y de la reacción que llevan a cabo.
A menudo las enzimas se asocian creando "cadenas de reacción" o "rutas de síntesis", en las que el producto de una enzima sirve de substrato para la siguiente, conformando así auténticas cadenas de montaje que tienen como resultado una o varias moléculas complejas.
Por ejemplo, este es el proceso por el cual el aminoácido tirosina sirve de precursor para la fabricación de dopamina y adrenalina, dos neurotransmisores cuya ruta de síntesis comienza con la conversión de la tirosina en L-DOPA facilitada por la tirosina hidroxilasa.
¿Qué interés tiene la biosíntesis en los procesos industriales?
La síntesis química nos permite generar nuevas moléculas que no existen en la naturaleza por medio de modificaciones químicas controladas. Algunas industrias, como la petroquímica, utilizan este tipo de síntesis para generar sus productos. En el caso de la producción de compuestos con una cierta actividad biológica, existen algunas limitaciones para la síntesis química que la biosíntesis puede solucionar. El primer ejemplo fue la fabricación de la penicilina, descubierta por Alexander Fleming en 1928 en algunas especies de hongos del género Penicillium. En los años 40, se logró optimizar las condiciones de fabricación de penicilina, cultivando estos hongos en grandes fermentadores, lo que consiguió reducir el coste de producción de 20 dólares por dosis en 1943 a 55 céntimos por dosis en 1946. Debido a la aparición de resistencias a antibióticos, se desarrollaron otras familias de penicilinas siguiendo dos estrategias: añadiendo precursores artificiales en el medio de cultivo del hongo productor, lo que conduce a la obtención de penicilinas biosintéticas, y la modificación química de la penicilina obtenida por fermentación biosintética, lo que da lugar a las penicilinas semisintéticas.
Otra ventaja de la biosíntesis es la estereoselectividad. La mayoría de las moléculas complejas presentan centros quirales, lo que significa que el mismo compuesto puede existir en distintas conformaciones tridimensionales. Como el guante de la mano derecha y el de la mano izquierda parecen idénticos, pero son en realidad distintos. Estas distintas conformaciones, llamadas estereoisómeros, suelen tener actividades biológicas muy diferentes, siendo por lo general solamente uno de ellos el activo desde un punto de vista farmacológico. Un famoso y fatídico ejemplo es el caso de la talidomida, una misma molécula con dos estereoisómeros, uno efectivo contra las náuseas del primer trimestre de embarazo y otro capaz de causar malformaciones en los fetos. Desde entonces, se tiene en cuenta el factor de la isomería en el desarrollo de fármacos. La síntesis química, salvo en el caso de las reacciones estereoselectivas en las que espontáneamente se forma un solo estereoisómero, suelen producir distintas cantidades de estereoisómeros conocidas como "mezclas racémicas", obligando a una posterior purificación de la molécula activa. Sin embargo, al estar facilitada por enzimas que restringen la conformación espacial de sus substratos y los orientan en un único sentido, la biosíntesis es capaz de producir sólo el isómero activo sin necesidad de una posterior purificación.
¿Cuándo llega la parte de clonar microorganismos?
Justo ahora. Los hongos del género Penicillium "fabrican" penicilina de manera natural porque están equipados con todas las enzimas necesarias para completar la "ruta de síntesis" de la misma. En el caso de otros compuestos biosintéticos, es necesario primero modelar a través de ingeniería genética el microorganismo que se va a utilizar para su "fabricación". Existen varios ejemplos de bacterias, hongos y levaduras modificados genéticamente para la producción de fármacos o precursores de los mismos. Estos microorganismos se denominan "recombinantes", ya que su genoma ha sido manipulado para incluir ADN externo y dotarlos de las enzimas necesarias para la transformación de substratos sencillos en productos complejos. Uno de los primeros ejemplos fue la producción de la insulina, un péptido producido por el páncreas que regula los niveles de azúcar en la sangre. Inicialmente, la insulina utilizada clínicamente por los pacientes diabéticos se obtenía del cerdo, ya que la insulina porcina y la insulina humana son prácticamente iguales, con la excepción de un solo aminoácido. Sin embargo, actualmente la insulina se produce en biorreactores donde crece un tipo de bacteria común, E. Coli, que ha sido modificada genéticamente para producirla de manera más cómoda y económica. Además de E. Coli, la bacteria más estudiada con fines de biosíntesis, la levadura de panadería, Saccharomyces Cerevisiae, también ha sido muy investigada tanto por su capacidad de almacenar mayores cantidades de ADN que las bacterias, así como el hecho de hacerlo en un formato más parecido al de los animales. Versiones recombinantes de S. Cerevisiae se han desarrollado para la producción del antimalárico artemisinina, descubierto en los años 70 por el premio nobel chino Youyou Tu. La artemisinina se extrae habitualmente de la planta Artemisia annua pero su producción agrícola no representa una fuente estable del producto que está sujeto a grandes fluctuaciones de precio (Peplow, 2013). Otro ejemplo utilizando S. Cerevisiae es la fabricación de morfina y otros opiáceos a partir de azúcares simples. La ruta de síntesis de los opiáceos es relativamente larga con casi una veintena de pasos. Distintos grupos han publicado la clonación de manera exitosa de partes de la cadena de síntesis en levadura pero aún no se ha conseguido incluir toda ella en un solo organismo (Ehrenberg, 2015). Este sería el primer paso para la producción por fermentación de opiáceos, cuyo origen de momento es la planta de la adormidera de la cual la empresa española Alcaliber es el segundo productor mundial.
¿Y esto se ha conseguido hacer con cannabinoides?
Exacto. El grupo de UC Berkeley ha conseguido incluir toda la maquinaria enzimática necesaria para fabricar cannabinoides en el interior de esta levadura y producir con éxito THCA y CBDA a escala de laboratorio (Figura 1). Distintas partes de la cadena de síntesis ya se habían clonado anteriormente en otros organismos como raíces de tabaco o Pichia Pastoris, pero esta es la primera vez que la fabricación puede realizarse a partir de la fermentación de azúcares sin necesidad de añadir un precursor o un intermedio de reacción (Luo et al., 2019). Sin embargo, todavía quedan importantes desafíos tecnológicos antes de poder optimizar la producción de cannabinoides por fermentación biotecnológica como pretenden algunas empresas que lideran el sector en términos de inversión de capital como las estadounidenses Amyris, Teewinot o Librede entre otras, y las canadienses Cronos Group, InMed y Organigram.
¿Cuáles son las ventajas e inconvenientes de la biosíntesis de cannabinoides?
Considerando el nivel de desarrollo técnico actual, podemos hacer una previsión de cuáles serían las consecuencias de la implementación de la biosíntesis para el sector agrícola de la industria del cannabis. Algunos aspectos importantes a tener en cuenta serían:
- Regulatorios: El cannabis es una substancia controlada y su cultivo, procesado y venta está estrictamente regulado. La posibilidad de producir sus principios activos sin necesidad de recurrir al cultivo de la planta supondría una ventaja desde el punto de vista legal.
- Económicos: Algunas compañías están estimando el coste de producción de cannabinoides a través de estas técnicas alrededor de 1000 dólares el kilo, entre 4 y 5 veces más barato que el cultivo de exterior, y alrededor de 30 veces más barato que la síntesis química convencional. Sin embargo, este aspecto tampoco es garantía de una ventaja competitiva en el mercado como es el caso anteriormente mencionado de la artemisinina.
- Ciclo de producción continuo: la fermentación se puede realizar de forma ininterrumpida mientras los métodos de agricultura tradicionales tienen ciclos de producción de 3-4 meses.
- Purificación de cannabinoides: el proceso de extracción y purificación sería teóricamente más sencillo comparado con el método de cultivo-cosechado-curado-extracción-purificación que implica la producción agrícola.
- Pureza y control de calidad: Más sencillo de certificar para cumplir las especificaciones de la fabricación farmacéutica.
- Capacidad para sintetizar cannabinoides poco abundantes o modificados estructuralmente.
Sin embargo, hay que tener en cuenta que existen serias limitaciones técnicas que la biosíntesis tendría que superar para convertirse en una estrategia de fabricación rentable y que, aún lográndolo, sigue presentando algunas limitaciones con respecto a la producción agrícola:
- La baja hidrosolubilidad de los cannabinoides hace que este proceso, que se realiza en un medio acuoso, pueda no conseguir alcanzar unos rendimientos de producción satisfactorios.
- Microorganismos capaces de producir aceites naturales, como es el caso de las algas, son mas difíciles de manipular genéticamente y su uso podría necesitar de precursores complejos como el cannabigerol (CBG).
- La biosíntesis se centra exclusivamente en la obtención de cannabinoides purificados con fines farmacéuticos que son idénticos a los que se obtienen a partir del cannabis herbal. Sin embargo, no permite la producción de extractos ricos en otros componentes de la planta que es, ahora mismo, uno de los productos más populares en el mercado recreativo y medicinal debido a la potencial interacción entre las moléculas activas presentes en los extractos vegetales que, actuando de manera sinérgica, mejorarían teóricamente el perfil de seguridad y eficacia de los cannabinoides.
- Del mismo modo, tampoco sustituye a la producción de flores de cannabis, o cannabis herbal que sigue siendo la opción preferida de consumo por muchos usuarios recreativos y pacientes que recurren a la automedicación.
Bibliografía
Ehrenberg, R., 2015. Engineered yeast paves way for home-brew heroin. Nature 521, 267–268. https://doi.org/10.1038/251267a
Luo, X., Reiter, M.A., d'Espaux, L., Wong, J., Denby, C.M., Lechner, A., Zhang, Y., Grzybowski, A.T., Harth, S., Lin, W., Lee, H., Yu, C., Shin, J., Deng, K., Benites, V.T., Wang, G., Baidoo, E.E.K., Chen, Y., Dev, I., Petzold, C.J., Keasling, J.D., 2019. Complete biosynthesis of cannabinoids and their unnatural analogues in yeast. Nature 567, 123–126. https://doi.org/10.1038/s41586-019-0978-9
Peplow, M., 2013. Malaria drug made in yeast causes market ferment. Nature 494, 160–161. https://doi.org/10.1038/494160a


