Door Guillermo Moreno-Sanz

Dr. Moreno-Sanz is auteur van meer dan 30 wetenschappelijke artikelen en eigenaar van drie octrooien die de rol van het endocannabinoïde systeem bij pijnperceptie beschrijven. Hij is afgestudeerd in Biochemie en Organische Scheikunde aan de Universiteit van Zaragoza en behaalde hij zijn PhD in Neurowetenschappen aan de Complutense Universiteit van Madrid, in Spanje. Hij deed uitgebreide internationale ervaring op met langdurige fellowships in Nederland, Italië en de Verenigde Staten. Het grootste deel van zijn academische carrière bracht hij door aan de University of California, Irvine, waar hij een nieuwe klasse cannabinoïde pijnstillers ontdekte met een hoog klinisch potentieel. In 2017 trad hij op als adviseur van de National Academies of Sciences van de Verenigde Staten bij de voorbereiding van het rapport 'The health effects of cannabis and cannabinoids' (De gezondheidseffecten van cannabis en cannabinoïden). Later richtte hij Abagune Research op om wetenschappelijk advies en R&D-oplossingen te verlenen aan de internationale cannabisindustrie. In 2020 heeft hij de wetenschappelijke en medische leiding van Khiron Life Sciences in Europa op zich genomen.
Een rat is geen aap is geen mens
In 2012 publiceerde de farmaceutische reus Pfizer de resultaten van de fase II klinische studie waarin de werkzaamheid werd onderzocht van het molecuul PF-04457845, een remmer van de afbraak van de endocannabinoïde anandamide, bij artrosepatiënten met chronische kniepijn. De resultaten van het onderzoek toonden aan dat deze krachtige remmer van het enzym FAAH in staat was het endocannabinoïde niveau te verhogen, maar patiënten meldden geen pijnstillend effect dat effectiever was dan het gebruik van ibuprofen, het controlemiddel.1
Dit resultaat was een teleurstelling voor iedereen die werkt aan de ontwikkeling van dit soort verbindingen. Sinds de ontdekking van het endocannabinoïde systeem in de jaren '90, was dit een van de meest veelbelovende klinische kandidaten voor het ontwikkelen van een medicijn dat het endocannabinoïde systeem klinisch zou kunnen exploiteren. Ik werk al vier jaar aan een vergelijkbare groep medicijnen, en voor mij was het resultaat zowel teleurstellend als intrigerend. Het is algemeen bekend dat de overgrote meerderheid van verbindingen die goed werken in diermodellen falen wanneer ze de klinische testfase met mensen bereiken. Het feit dat FAAH-remmers werkzaam zijn in diermodellen van zeer uiteenlopende soorten pijn (nociceptief, inflammatoir, neuropathisch, enz.), samen met bewijs uit de praktijk dat keer op keer het wijdverbreide gebruik van medicinale cannabis voor chronische pijnverlichting bevestigt, maakte deze technologie veelbelovend voor de ontwikkeling van een nieuwe klasse pijnstillers met een gunstig veiligheidsprofiel. Toen het resultaat eenmaal was verwerkt, begon de wetenschappelijke gemeenschap de grondgedachte achter het resultaat van Pfizer in twijfel te trekken. Een van de pioniers van de anandamide-farmacologie, Vincenzo Di Marzo, onderzocht in een redactioneel artikel op zijn manier de verschillende redenen waarom pijnbestrijding door stimulatie van de endocannabinoïde toon misschien niet zo gemakkelijk is als aanvankelijk werd verwacht.2 Een van de belangrijkste argumenten die Di Marzo aanvoerde, was dat cannabinoïden doeltreffend bleken te zijn bij chronische pijnaandoeningen van patiënten die een hogere mate van angst hadden. Zelfs de onderzoekers van het Pfizer-onderzoek suggereerden dat de lage affectieve component van het gebruikte model mogelijk heeft bijgedragen aan het gebrek aan werkzaamheid van onderzoeksmiddel PF-04457845.
Dit deed me denken aan een recensie die ik een paar jaar eerder had gelezen toen ik nog een PhD-student was, waarin experts in de neurologische pijnverwerking uitlegden dat ratten en andere lagere zoogdieren simpelweg niet over de neuroanatomische structuren beschikken die verantwoordelijk zijn voor pijnverwerking bij mensen.3 Ik heb er toen niet veel aandacht aan besteed, omdat ik in de laatste fase van mijn PhD-onderzoek zat en het laatste waaraan je wilt denken voordat je je proefschrift verdedigt, is of je echt iets nuttigs aan het doen bent. Maar sinds ik begon te werken met patiënten die medicinale cannabis gebruikten, is dit modulerende effect van het endocannabinoïde systeem op de affectieve component van chronische pijn een van de sleutelfactoren die de waargenomen reacties in de klinische praktijk verklaren.
Pijnintensiteit, pijngrens en lijden
Huidig bewijs geeft duidelijk aan dat de belevenis van chronische pijn bij mensen bestaat uit zowel sensorische als affectieve dimensies. Het gaat vaak gepaard met het verlangen om een einde te maken aan de pijn, de pijn te verminderen of eraan te ontsnappen. Deze affectieve dimensie van pijn bestaat voor een deel uit emoties die verband houden met het heden of de korte termijn toekomst van de patiënt, zoals leed of angst. Een andere affectieve component van pijn, het 'secundaire affect', bestaat uit gevoelens die gemotiveerd worden door de langetermijngevolgen van chronische pijn, zoals lijden. Het secundaire affect is gebaseerd op een uitgebreidere beschouwing, beïnvloed door herinneringen, geheugen en anticipatie, over het verlies van autonomie en kwaliteit van leven, de moeilijkheden van het verdragen van langdurige pijn en de implicaties voor de toekomst en overleving van de patiënt. Chronische pijn wordt dus vaak niet alleen ervaren als een bedreiging voor de huidige toestand van het lichaam, comfort of de dagelijkse activiteiten, maar ook voor het toekomstige welzijn en het leven in het algemeen.4
Maar wat is dan het effect van cannabinoïden op het affectieve aspect van pijn? Een meta-analyse van laboratoriumstudies op mensen, waarin behandelingen worden getest op gezonde vrijwilligers die worden blootgesteld aan pijnlijke prikkels in plaats van op echte patiënten, concludeerde dat de toediening van medicijnen op basis van cannabinoïden het begin van pijn voorkwam door een kleine verhoging van de pijndrempel te produceren, maar het bracht geen vermindering van de intensiteit van pijn die al werd ervaren. Integendeel, cannabinoïden maakten de pijn minder onaangenaam en draaglijker voor de deelnemers, wat suggereert dat het effect heeft op de emotionele verwerking van pijn.5 In een van de experimenten die onderdeel zijn van deze meta-analyse, beschreven deelnemers die THC in combinatie met morfine kregen een synergetisch effect op de vermindering van het waargenomen ongemak, maar niet op de pijnintensiteit. De auteurs gebruikten de vergelijking met een radio om deze twee componenten uit te leggen: één dimensie komt overeen met het volume waarop naar de radio wordt geluisterd, harder of zachter. De andere komt overeen met hoe irritant de radio is. Dit is een subjectieve waarde die meer kwalitatief dan kwantitatief is en mogelijk wel of niet te maken heeft met het volume of de intensiteit.6 Dit resultaat komt overeen met de resultaten uit observationele studies van chronische patiënten die een medicinale cannabisbehandeling ondergaan. Deze patiënten melden slechts een kleine verbetering op de waargenomen pijnintensiteit, maar ervaren daarentegen een sterke invloed op de levenskwaliteit rondom hun aandoening en een grote verbetering van psychiatrische comorbiditeiten zoals stemming, angst, stress of slaapkwaliteit.7
De herinnering aan pijn
Maar hoe moduleren cannabinoïden selectief de affectieve component van pijn? Hoewel het antwoord nog niet duidelijk is, hebben we enkele aanwijzingen die afkomstig zijn uit hersenscanonderzoeken waarbij deelnemers een pijnlijke prikkel toegediend krijgen. Hierin wordt waargenomen dat de toediening van THC de toename van neuronale activiteit in de anterieure cingulate cortex (ACC) kan blokkeren. Dit is de hersenstructuur die verantwoordelijk is voor het overbrengen van pijnlijke informatie naar hogere kernen waar het wordt geïntegreerd in herinneringen en ervaringen om de affectieve reacties te creëren. Juist dit pad ontbreekt bij lagere dieren zoals ratten, die een veel directere en minder complexe reactie op pijnlijke prikkels produceren.8 Tegelijkertijd weten we dat de activering van cannabinoïde receptor 1, het gedeelde doelwit van anandamide en THC, in een ander deel van de hersenen, de amygdala, een sleutelrol speelt bij het uitsterven van aversieve herinneringen die verband houden met negatieve of traumatische ervaringen. Herhaalde ervaringen worden in het geheugen gegrift, en aanhoudende pijnlijke ervaringen creëren een herinnering aan pijn. Angst en verdriet spelen een dominante rol in het leven van chronische patiënten die voortdurend leven met de verwachting dat de pijn zal verschijnen. Specialisten benadrukken het belang ervan om deze angst aan te pakken door pijnvrije ruimtes te creëren en zo de patiënt een gevoel van controle te geven. Dit vermindert ook het algemene gevoel van angst of onrust. Misschien is dit een van de redenen waarom cannabinoïden, die invloed zouden hebben op de verwerking van de affectieve componenten van pijnlijke prikkels en het uitsterven van negatieve herinneringen die samenhangen met chronische pijn, effectiever zouden zijn bij patiënten met psychiatrische comorbiditeiten zoals stress, angst en depressie, wat het geval is bij de meerderheid van patiënten die lijden aan chronische pijn. Het beschikbare bewijs lijkt aan te tonen dat het voortdurende gebruik van cannabinoïden bij dit soort patiënten hun gedrag kan verbeteren, zoals het verminderen van doemdenken en zowel overdag als 's nachts voortdurend piekeren, wat de acceptatie, veerkracht en positieve gedachten over iemands gezondheid bevordert (zie afbeelding ).9
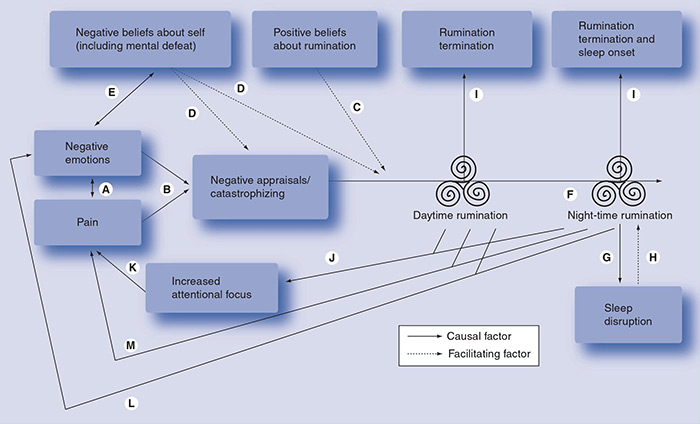
Deze hersengebieden, de ACC en de amygdala, spelen ook een rol bij de abnormale verwerking van aversieve prikkels bij psychiatrische patiënten. Observationele studies hebben een significante toename van de communicatie tussen deze twee gebieden, de ACC en de amygdala, vastgesteld tijdens angstige emotionele processen bij patiënten met een diagnose van angststoornissen, maar niet bij gezonde vrijwilligers. Bovendien was deze verhoogde hersenactiviteit positief gecorreleerd met angstige symptomen beschreven door de patiënten.10 Om deze reden kunnen medicijnen op basis van cannabis een effectieve aanvulling vormen op een multimodaal farmacologisch behandelplan, niet alleen voor chronische pijn, maar ook voor andere slopende chronische aandoeningen met een traumatische component zoals angststoornissen, waaronder sociale angst of gegeneraliseerde angst, of een post-traumatische stress-stoornis.
Een zucht van opluchting
Maar wat betekent al deze modulatie van neuronale processen voor de patiënt? In kwalitatieve onderzoeken die de ervaring bestuderen van patiënten die cannabis voor medicinale doeleinden gebruiken, zijn er twee terugkerende indrukken die in de meeste verslagen voorkomen: de eerste is de 'zucht van verlichting', een uitdrukking die patiënten vaak gebruiken om het effect te beschrijven dat ze ervaren na het inhaleren van cannabis. Een gevoel van lichamelijke en geestelijke ontspanning dat de patiënt toegang geeft tot een tweede gevoel, 'het herstel van de zelf'.11 Patiënten beschrijven hoe het gebruik van medicinale cannabis hen in staat stelt om zichzelf weer te vinden, de persoon die ze waren voordat ze ziek werden, om dagelijkse activiteiten uit te voeren waar ze plezier aan beleefden, zoals het verzorgen van hun planten, met hun gezin wandelen of uit eten gaan. Kortom, het verbeteren van de levenskwaliteit, dat gevoelige evenwicht tussen de angst voor de ziekte en de liefde voor het eigen bestaan.
1. Huggins, J. P., Smart, T. S., Langman, S., Taylor, L. & Young, T. An efficient randomised, placebo-controlled clinical trial with the irreversible fatty acid amide hydrolase-1 inhibitor PF-04457845, which modulates endocannabinoids but fails to induce effective analgesia in patients with pain due to osteoarthritis of the knee. Pain 153, 1837-1846 (2012).
2. Di Marzo, V. Inhibitors of endocannabinoid breakdown for pain: not so FA(AH)cile, after all. Pain 153, 1785-1786 (2012).
3. Craig, A. D. A rat is not a monkey is not a human: Comment on Mogil (Nature Rev. Neurosci. 10, 283-294 (2009)). Nat. Rev. Neurosci. 10, 466 (2009).
4. Price, D. D. Psychological and Neural Mechanisms of the Affective Dimension of Pain. Science (80-. ). 288, 1769-1772 (2000).
5. De Vita, M. J., Moskal, D., Maisto, S. A. & Ansell, E. B. Association of Cannabinoid Administration With Experimental Pain in Healthy Adults: A Systematic Review and Meta-analysis. JAMA psychiatry 75, 1118-1127 (2018).
6. Roberts, J. D., Gennings, C. & Shih, M. Synergistic affective analgesic interaction between delta-9- tetrahydrocannabinol and morphine. Eur. J. Pharmacol. 530, 54-58 (2006).
7. Moreno-Sanz, G., Madiedo, A., Lynskey, M. & Brown, M. R. D. 'Flower Power': Controlled Inhalation of THC-Predominant Cannabis Flos Improves Health-Related Quality of Life and Symptoms of Chronic Pain and Anxiety in Eligible UK Patients. Biomed. 2022, Vol. 10, Page 2576 10, 2576 (2022).
8. Lee, M. C. et al. Amygdala activity contributes to the dissociative effect of cannabis on pain perception. Pain 154, 124-134 (2013).
9. Edwards, M. J., Tang, N. K., Wright, A. M., Salkovskis, P. M. & Timberlake, C. M. Thinking about thinking about pain: a qualitative investigation of rumination in chronic pain. http://dx.doi.org/10.2217/pmt.11.29 1, 311-323 (2011).
10. Robinson, O. J. et al. The dorsal medial medial prefrontal (anterior cingulate) cortexâ€"amygdala aversive amplification circuit in unmedicated generalised and social anxiety disorders: an observational study. The Lancet Psychiatry 1, 294-302 (2014).
11. Lavie-Ajayi, M. & Shvartzman, P. Restored Self: A Phenomenological Study of Pain Relief by Cannabis. Pain Med. 20, 2086-2093 (2019).