Door Tanja Bagar

Dr. Tanja Bagar is een microbioloog met een doctoraat in de biogeneeskunde. Ze heeft uitgebreide onderzoekservaring opgedaan in de biotechnologie, moleculaire biologie en celsignalering in laboratoria in Slovenië, Duitsland en het VK. Ze heeft zich met name gericht op het endocannabinoïde systeem en de actieve stoffen uit cannabis/hennep. Haar werk leidde tot de oprichting van het Internationale Instituut voor Cannabinoïden (ICANNA), waar ze de CEO is en voorzitter van de Expert Council. Ze is ook adjunct-directeur en hoofd R&D bij een milieubedrijf. Ze is ook actief op academisch gebied. Ze doceert microbiologie en is de decaan van de masteropleiding Ecoremediaties aan de faculteit Alma Mater Europaea.
Autofagie is een evolutionair zelfreinigend programma dat plaatsvindt in onze cellen. Het woord 'autofagie' betekent letterlijk 'zichzelf eten' en is afgeleid van de Griekse woorden 'auto', wat 'zelf' betekent, en 'fagie' dat 'eten' betekent. Het woord werd bedacht door Nobelprijswinnaar Christian de Duve: een Belgische celonderzoeker die samen met twee collega's in 1974 de Nobelprijs ontving voor hun ontdekkingen over de structurele en functionele organisatie van cellen.
In 2016 werd de Nobelprijs toegekend aan een Japanse onderzoeker, Yoshinori Ohsumi, die het proces van autofagie verder bestudeerde. Tijdens het proces van autofagie worden beschadigde cellulaire componenten, ongebruikte eiwitten en ander cellulair afval opgenomen in een blaasje, een autofagosoom genaamd, net zoals huishoudelijk afval in vuilniszakken wordt verpakt. Bij mensen worden de blaasjes getransporteerd naar een lysosoom, of een celorganel. Deze organellen hebben een vergelijkbare functie als die van een recyclingfabriek: de materialen die in de autofagosomen worden geleverd, worden afgebroken en gerecycled, zodat de afzonderlijke componenten kunnen worden hergebruikt. In menselijke cellen omvat autofagie de vorming van een bekervormig element met dubbele membranen, een fagofoor. Deze omsluit het af te breken materiaal en vormt een bolvormig autofagosoom met dubbele membranen. Het buitenste membraan van het autofagosoom versmelt uiteindelijk met een lysosoom om een autolysosoom te vormen, wat resulteert in de afbraak van het binnenste autofagosoom, het membraan en de ingesloten materialen.
Hoe vindt autofagie eigenlijk plaats?
Dankzij het werk van verschillende baanbrekende wetenschappers begrijpen we nu het basisconcept van autofagie. Het werd meestal onder de microscoop waargenomen, wanneer cellen een tekort aan voedingsstoffen hadden en dus uitgehongerd waren. Maar hoe meer wetenschappers naar dit proces keken, hoe duidelijker het werd dat deze 'simpele' recycling in feite een complex cellulair proces was. Hoewel het voornamelijk in gistcellen is bestudeerd, lijkt het veel op het proces in menselijke cellen.
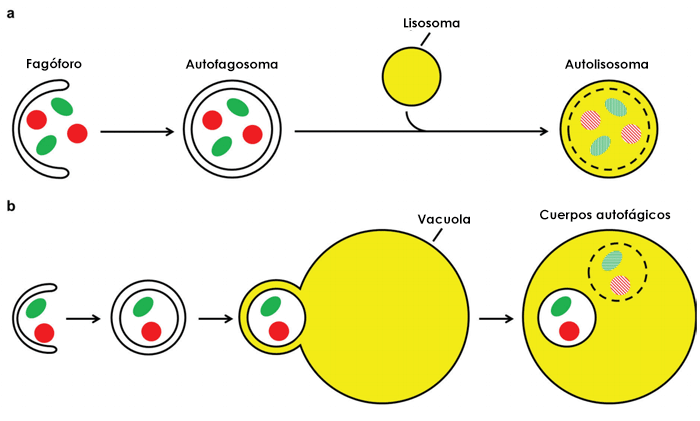
Figuur 1: Autofagiebaan in menselijke cellen (a) en gist (b). Bron: Frake, Becca & Rubinsztein, David. (2016). Yoshinori Ohsumi's Nobel Prize for the mechanisms of autophagy: From basic yeast biology to therapeutic potential. Journal of the Royal College of Physicians of Edinburgh. 46. 228-233. 10.4997/JRCPE.2016.403.
(a) In menselijke cellen sluit de fagofoor zich om het cytoplasmatisch materiaal en vormt een bolvormige autofagosoom met dubbele membranen. Het buitenste membraan van de autofagosoom versmelt met een lysosoom om een autolysosoom te vormen, wat resulteert in de afbraak van het binnenste autofagosoom membraan en de aanwezige materialen.
(b) Het proces is vergelijkbaar met wat er in gist gebeurt, behalve dat het buitenste membraan van het autofagosoom versmelt met de vacuole. Deze fusie vormt autofagische lichamen met een enkel membraan in de vacuole die worden afgebroken, samen met de meegevoerde lading.
Autofagie is een mechanisme dat de cellulaire homeostase in stand houdt en een soort 'huishoudelijke' rol speelt in normale fysiologische processen, door materialen en energie in de cellen te hergebruiken. Ondanks dat het een essentieel proces is, is het niettemin zeer strikt gereguleerd. Er is ontdekt dat cellen die een gebrek aan voedingsstoffen hebben, met andere woorden uitgehongerde cellen, het autofagieproces in gang zetten. Blijkbaar leidt een tekort aan aminozuren - de bouwstenen van eiwitten - in bepaalde gevallen tot verhoogde autofagie. Deze bevindingen waren een van de redenen waarom intermitterend vasten en diëten met wisselende hoveelheden eiwitten (protein cycling) bekendheid hebben gekregen. We beginnen met het veroorzaken van een tekort aan voedingsstoffen door 12-16 uur te vasten, wat de autofagie in gang zet. Ook kunnen we de inname van eiwitten op bepaalde dagen beperken om het gebrek aan aminozuren na te bootsen en zo de autofagie op gang te brengen en onze cellen en ons lichaam te vernieuwen. Het is ook aangetoond dat lichaamsbeweging genen activeert die de autofagie starten, wat de rol van een gezonde levensstijl nog eens onderstreept.
Rapamycine is de eerste stof waarvan is bewezen dat deze autofagie veroorzaakt. Rapamycine werd eerst aangewezen als een immuniteitonderdrukker en werd gebruikt om niertransplantatiepatiënten te behandelen. Later onderzoek toonde aan dat de stof veel meer effecten heeft: het vermindert het risico op CMV-infectie bij orgaantransplantatiepatiënten, verbetert de antipathogene en anti-kankerimmuniteit bij muizen, verlengt de levensduur bij infectiegevoelige muizen en beschermt oudere muizen tegen longontsteking. De effecten worden meestal tot stand gebracht via autofagie. Later in dit artikel zullen we ook zien dat sommige natuurlijke componenten autofagie kunnen veroorzaken.
De rol van autofagie bij gezondheid en ziekte
Autofagie is essentieel voor de gezondheid, maar kan een cytoprotectieve of cytopathische rol spelen, afhankelijk van de vele signalen en stressfactoren waaraan de cellen worden blootgesteld. Onderzoekers en artsen hopen dat we, door het beïnvloeden van de autofagie, ziekteprocessen kunnen beïnvloeden, zodat autofagie een belangrijk farmacologisch doelwit wordt. Het heeft veel effecten op veel verschillende aandoeningen, maar dit artikel zal kort ingaan op de rol bij infectie en immuniteit.
Infectie door pathogenen gaat gepaard met de activering van het immuunsysteem van de gastheer, en autofagie maakt deel uit van de reactie om de pathogenen te elimineren. Voor een succesvolle immuunrespons moeten intracellulaire bacteriën en virussen gedood en geëlimineerd worden. Aangezien autofagie de afbreking van het zelf is, wordt het 'xenofagie' genoemd (afbreking van iets vreemds) wanneer het proces pathogenen afbreekt. Dit is misschien wel de oudste vorm van verdediging tegen binnendringende ziekteverwekkers. Autofagie wordt geactiveerd bij de meeste bacteriële infecties. Er is ontdekt dat groepen van zeer veelvoorkomende en krachtige ziekteverwekkende bacteriën, zoals Groep A-streptokokken, Salmonella typhimurium en Mycobacterium tuberculosis, door autofagie worden afgebroken en afgevoerd, zoals weergegeven in figuur 4. Vergelijkbare resultaten zijn aangetoond voor veel andere pathogene bacteriën. De effecten van sommige medicijnen zijn ook gebaseerd op de stimulering van autofagie, zoals de antimycobacteriële effecten die calcimycine gebruikt voor Mycobacterium bovis-infecties. Sommige bacteriën vinden ook manieren om afbraak door autofagie te voorkomen. Bij virale infecties speelt autofagie een antivirale en mogelijk ook een pro-virale rol. Enerzijds richten de autofagie-eiwitten zich op virale delen voor afbraak, terwijl ze ook een rol spelen bij het initiëren van aangeboren en adaptieve immuunreacties op virale infecties. Net als bij sommige bacteriën, kunnen sommige virussen interageren met het autofagiemechanisme en het blokkeren. Sommige virussen kunnen ook componenten van het autofagisch mechanisme gebruiken voor hun eigen groei en replicatie.
Niet alleen de eliminatie van pathogenen, maar ook vele andere aspecten van adaptieve en aangeboren immuniteit worden gereguleerd door autofagie, zoals antigeenpresentatie, cytokine- en interferonproductie - het moduleren van ontstekingen en lymfocytontwikkeling.
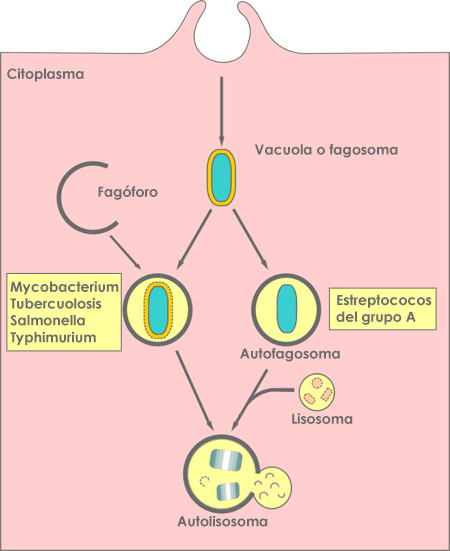
Figuur 4: Schema van de manieren waarop autofagie de intracellulaire bacteriën aanvalt. Bron: Huang J, Brumell JH. Bacteria-autophagy interplay: a battle for survival. Nat Rev Microbiol. 2014;12(2):101-114. doi:10.1038/nrmicro3160.
Het is nu bekend dat gebreken in de autofagieregulatie een belangrijke rol spelen bij een aantal ziekten, waaronder neurodegeneratieve ziekten, kanker en stofwisselingsziekten. Onze kennis van autofagie suggereert dat, als we weten hoe we autofagie op het juiste moment moeten in- en uitschakelen, we in staat zullen zijn om het ontstaan en de ontwikkeling van meerdere ziekten kunnen beïnvloeden.
Autofagie en cannabinoïden
Nu we weten hoe belangrijk autofagie is, rijst natuurlijk de vraag: hoe wordt het beïnvloed door cannabinoïden? Van verschillende planten en hun ingrediënten is bekend dat ze autofagie stimuleren, zoals citrusbergamot, groene thee, kaneel en resveratrol. Verschillende onderzoeken hebben de rol van cannabinoïden bij autofagie onderzocht en er is aangetoond dat cannabinoïden meestal autofagie induceren in gezonde en tumorcellen. Het aanzetten tot autofagie kan goed of slecht zijn, afhankelijk van de toestand waarin de cel zich bevindt. Hoewel een minimaal niveau van autofagie vereist is voor de overleving van cellen of organismen, kan de langdurige activering van autofagie of autofagie-inductie op het verkeerde moment nadelige effecten hebben.
In de eerste levensfasen is de wisselwerking tussen het endocannabinoïde systeem en autofagie al erg belangrijk. Direct na de bevruchting, tijdens de embryonale ontwikkeling, wordt autofagie sterk geactiveerd in bevruchte eicellen, zelfs vóór implantatie. Er wordt aangenomen dat autofagie nodig is tijdens de vroege embryonale ontwikkeling om de niet langer benodigde maternale eiwitten en mRNA af te breken. We weten dat autofagie in de eerste dagen van de zwangerschap meestal op basale niveaus wordt gehandhaafd in blastocysten, maar bij muizen neemt het drastisch af op dag 4, wanneer het tijdstip van implantatie nadert. Op dit moment zijn de anandamide concentraties in de baarmoeder enorm verminderd, wat een duidelijke correlatie laat zien tussen de anandamide concentratie en autofagie in blastocysten.
Dit toont aan dat endocannabinoïden potentiële regulatoren van autofagie kunnen zijn. Aangezien de productie van voldoende hoeveelheden anandamide en de inductie van autofagie cruciaal zijn voor de embryonale ontwikkeling en implantatie bij muizen, kunnen vroegtijdige verhogingen van het anandamide gehalte leiden tot autofagische activering in embryo's op ongewenste momenten, wat celdood veroorzaakt bij muizenembryo's. Vergelijkbare resultaten zijn aangetoond door een selectieve agonist voor CB1R (METH) toe te voegen, die ook autofagie activeert. 7 nM METH wordt erkend als de gezonde fysiologische dosis voor embryo's, terwijl 28 nM METH nadelige effecten heeft op de zwangerschap bij muizen en schapen. Als METH werd geïnjecteerd op dag 4, wanneer anandamide en autofagie normaal gesproken laag zouden zijn, of als muizen werden blootgesteld aan verhoogde METH in de eerste dagen van de zwangerschap, werd de autofagie geactiveerd. Als gevolg daarvan vond de implantatie niet plaats en volgde het verlies van de embryo's.
Dit onderstreept het belang van autofagie op het juiste moment. Omdat zowel het autofagie- als het endocannabinoïde systeem functioneren om de homeostase in de cellen en het lichaam te behouden, is het verband tussen deze twee niet verrassend. Endocannabinoïden worden lokaal, op verzoek geproduceerd, op basis van signalen uit de omgeving, waardoor ze snelle, ideale inductoren van autofagie zijn.
Fytocannabinoïden kunnen ook autofagie veroorzaken. In 2009 werd aangetoond dat THC celdood veroorzaakt in menselijke glioomcellen, tumorxenotransplantaten en menselijke tumormonsters, voornamelijk via autofagie, maar niet in normale neuronale cellen. Glioom-stamachtige cellen komen overeen met een subpopulatie van tumorcellen die resistent is tegen chemotherapie. CBD stimuleert het autofagische proces in deze cellen en remt hun proliferatie en klonogene vermogen. Bovenal veroorzaakt de combinatie van CBD en het chemotherapiemedicijn celdood en remt het de tumorgroei.
In borstkankercellen verhoogt CBD autofagie, waarbij Beclin-1 een centrale rol speelt bij de inductie. Het effect van CBD was receptoronafhankelijk, voornamelijk via oxidatieve stress en de effecten ervan op mitochondriën. Het is ook aangetoond dat een cannabinoïde derivaat, O-1663 (CBR2-agonist) autofagie en apoptose induceert in borstkankercellen, vooral in uitgezaaide kankercellen. Daarom speelt CBG, een fytocannabinoïde met affiniteit voor CBR2, een belangrijke rol in de behandeling van borstkanker.
CBD bleek ook op een dosisafhankelijke manier autofagie te induceren in volledig gedifferentieerde Caco-2-cellen, een model van volwassen darmepitheel. In dit model induceerden CBR1-agonist ACEA en anandamide ook onafhankelijk van elkaar autofagie via cannabinoïde type 1-receptor en de CBD-receptor. Dit zou een van de mechanismen kunnen zijn die de therapeutische toepassingen van de cannabinoïden bij inflammatoire darmaandoeningen verklaren. Een combinatie van gelijke delen THC en CBD (ook bekend als Sativex®) bleek de afzetting van Tau en amyloïd in de hippocampus en de hersenschors te verminderen, in een muismodel van complexe neurodegeneratieve aandoeningen, via verschillende mechanismen, waaronder de stimulatie van autofagie, wat wijst op het mechanisme achter de neuroprotectieve eigenschappen van cannabinoïden.
Conclusie
In gezonde cellen draagt de inductie van autofagie bij aan een betere orgaanfunctie en langzamere veroudering. Ook is het interessant dat er aangetoond dat CBD muizenlevercellen beschermt tegen acute door alcohol geïnduceerde steatose via meerdere mechanismen, waaronder de activering en verhoging van de autofagie. Bij kanker werd aangetoond dat de manier waarop cannabinoïden interageren met tumorcellen afhangt van het type tumor, de specifieke cannabinoïde en de specifieke kenmerken van de cannabinoïde receptoren, maar uiteindelijk leidt het tot autofagie. De gevolgen van de activering van autofagie worden echter nog niet in alle pathologische situaties helemaal begrepen. In sommige gevallen werkt autofagie als een doodsmechanisme of als een cytoprotectief mechanisme, afhankelijk van de cellulaire context en de kracht en duur van de triggerende stimulus. Er is nog veel dat we moeten ontdekken en we hopen dat de nabije toekomst meer antwoorden zal brengen over hoe en wanneer cannabinoïden voor autofagie bij diverse ziekten kunnen worden gebruikt. Er bestaat echter geen enkele twijfel dat cannabinoïden de activering van autofagie bevorderen en het biochemische evenwicht in cellen, organen, weefsels en het hele lichaam en geest beter in stand houden.


