Por Kyle Boyar

Kyle Boyar es un científico especializado en cannabis con experiencia en neurobiología y química analítica que lleva seis años trabajando en la industria. Kyle obtuvo su licenciatura en neurociencia en la Universidad de California Santa Cruz y, anteriormente, trabajó como Director de laboratorio para SC Laboratories. Kyle trabaja actualmente como científico de aplicación de campo en Medicinal Genomics, donde asiste a los laboratorios de prueba de cannabis y a los productores con pruebas de contaminantes microbianos, patógenos de plantas y rasgos genéticos. Además de su trabajo en Medicinal Genomics, también es el Presidente del Comité de Becas y Coordinador de Medios Sociales de la Subdivisión de Química del Cannabis de la Sociedad Americana de Química.
Según las Naciones Unidas, 158,8 millones de personas en todo el mundo consumen cannabis, más del 3,8 % de la población mundial. El cannabis se puede administrar a través de diversos medios, como inhalación, ingestión oral o aplicación tópica, solo por mencionar algunos.
Cada producto y vía de administración única presenta sus propias consideraciones microbiológicas. Esto es, en parte, la razón por la cual las pruebas de seguridad de terceros se han convertido en un mandato obligatorio en los mercados de cannabis tanto médicos como recreativos. En el contexto de las pruebas microbiológicas, la industria del cannabis ha optado por adoptar métodos comúnmente utilizados en la industria alimentaria, como los sistemas de placas y cultivos. Sin embargo, la secuenciación del microbioma de cannabis y el análisis de los datos producidos por muchos de estos métodos han arrojado luz sobre varias ineficiencias y dificultades de las prácticas comúnmente utilizadas y crean un fuerte argumento para el uso de métodos moleculares [1-2].
¿Por qué se necesitan pruebas microbianas?
Las pruebas microbianas son esenciales para garantizar que los consumidores de cannabis no estén expuestos a contaminantes dañinos. Para los individuos sanos, algunos contaminantes microbianos son relativamente inocuos. Esto es especialmente importante para los pacientes que usan cannabis para tratar una condición, ya que muchos de ellos tienen sistemas inmunológicos comprometidos, lo que los hace particularmente susceptibles a contraer enfermedades debido a la contaminación microbiana. El riesgo más frecuente para estos pacientes es la aspergilosis, una infección respiratoria causada por la inhalación de esporas de Aspergillus que puede ser mortal si no se trata. Hay casos documentados de esta infección en pacientes inmunocomprometidos que derivan del consumo de cannabis contaminado con esporas de Aspergillus [3-15]. Un estudio de caso reciente mostró que esta infección no siempre se limita al sistema inmunológico comprometido e incluso puede producirse en individuos sanos [16]. También se han documentado casos de brotes de Salmonella debido al cannabis contaminado [17].
¿Para qué tipos de contaminantes microbianos se realizan análisis en laboratorio?
En ausencia de requisitos microbianos universales, ha estado en su mayoría en manos de los organismos reguladores, así como de las jurisdicciones locales y estatales, determinar qué tipos de contaminantes deben analizarse los laboratorios de análisis de cannabis. Actualmente, muchos laboratorios están realizando pruebas de recuento total dirigidas a grandes grupos microbianos que se consideran organismos indicadores, tales como: bacterias aerobias, coliformes, enterobacterias y levaduras y mohos. Si bien estas pruebas pueden proporcionar información sobre la carga microbiana en una muestra, no pueden diferenciar entre microorganismos dañinos y benignos. Algunos estados son conscientes de estos inconvenientes y han optado por pruebas específicas de especies para patógenos humanos conocidos como Salmonella, E. coli productora de toxina Shiga (STEC) y ciertas especies de Aspergillus. Estas pruebas específicas de patógenos proporcionan información mucho más útil en el contexto de la seguridad del consumidor.
Sin embargo, los microbios en sí mismos no son el único motivo de preocupación para los consumidores de cannabis. Algunos contaminantes fúngicos también pueden producir metabolitos secundarios dañinos llamados micotoxinas. Estos compuestos son altamente tóxicos incluso en niveles bajos y pueden conducir a enfermedades, y en algunos casos pueden ser fatales. Por ejemplo, el Aspergillus es un contaminante común que se encuentra en el cannabis y algunas especies pueden producir micotoxinas, tales como aflatoxina y ocratoxina. Estos compuestos son conocidos mutágenos y carcinógenos que son tóxicos para el hígado. La secuenciación del ADN de los microbiomas de cannabis también ha revelado organismos adicionales que podrían producir compuestos preocupantes. Penicillium citrinum y Penicillium paxilli son hongos que se encuentran comúnmente en el cannabis que produce las micotoxinas citrinina y paxillina. Estos compuestos bloquean ciertos canales iónicos en el cerebro y podrían tener serias implicaciones para afecciones como la epilepsia. Específicamente, se ha demostrado que la paxillina produce temblores y se ha demostrado que atenúa las propiedades anticonvulsivas de la CDB en modelos de ratón [18]. De manera similar, la citrinina es otra micotoxina que interrumpe ciertas vías mitocondriales con las que CDB interacciona para proporcionar una reducción de los ataques [19]. Considerando que se administra CBD para lograr concentraciones en la concentración de µM y estas toxinas pueden tener efectos negativos en la concentración de nM, la presencia de estos microbios en numerosas muestras de cannabis es motivo de preocupación. Algunos estados han optado por exigir pruebas para estos contaminantes fúngicos; sin embargo, no es un requisito de prueba universal, por lo que muchos laboratorios no los están evaluando.
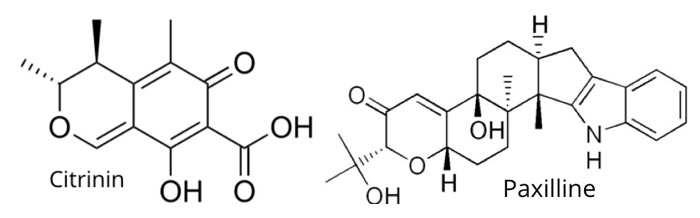
Figura 2: Citrinina y paxilina son micotoxinas derivadas de Penicllium citrinum y Penicillium paxilli que podrían interferir con las propiedades antiepilépticas del cannabidiol (CDB).
¿Cuáles son los métodos comúnmente utilizados para las pruebas microbianas del cannabis?
Uno de los métodos de cultivo de cannabis más utilizados es el 3M Petrifilm. Estas películas son versiones compactas de placas Petri que utilizan medios antibióticos selectivos y una química de lectura específica que permite la enumeración de ciertos microorganismos. Otros métodos basados en cultivos que se utilizan en el campo de las pruebas de cannabis incluyen Tempo & Vidas de Biomerieux, así como BioLumix, que también emplean métodos similares de detección para ciertas clases de microorganismos. También hay métodos basados en la química analítica, tales comoespectrometría de masas de tiempo de vuelo con ionización por desorción asistida por matriz (MALDI-TOF-MS), que es capaz de identificar contaminantes microbianos en el nivel de clase y subespecie más amplios en función de la presencia de ciertas macromoléculas. asociado a un determinado microbio. Esta metodología se está utilizando actualmente en el mundo clínico y ofrece un método rápido para la detección microbiana, sin embargo, los costes asociados son bastante altos, ya que estos instrumentos pueden costar más de medio millón de dólares [20]. Alternativamente, la qPCR es un método molecular basado en el ADN que permite la medición de una diana de ADN asociada con un contaminante dado utilizando una molécula indicadora fluorescente. Debido a los menores costes de instrumentación y al aumento de la sensibilidad, la qPCR es a menudo la metodología de este tipo de prueba de determinación de patógenos. En lo que respecta a las pruebas de micotoxinas producidas por contaminantes microbianos, la cromatografía líquida acoplada a espectrometría de masas en tándem (LC-MS-MS) es generalmente la metodología preferida, aunque existen otros métodos menos sensibles.
¿Cómo se diferencian estos métodos entre sí?
La comparación de estos métodos es como las manzanas y las naranjas por varias razones.
- El 99 % de los microbios no se cultivan [21], por lo que los métodos de cultivo solo son capaces de detectar un pequeño subconjunto de microorganismos.
- El acto de cultivar cambia la carga microbiana. Debido a que el cultivo consiste esencialmente en proporcionar un medio que estimule ciertos tipos de crecimiento microbiano, algunas especies son favorecidas sobre otras y superan a otras. Esto produce una imagen muy diferente de la que está inicialmente presente en la muestra y causa una imagen distorsionada de las comunidades microbianas presentes en el material de cannabis o productos de cannabis.
- Diferencias en la selectividad: los métodos de siembra tradicionales suelen depender de los antibióticos para su selectividad, mientras que la qPCR y la MALDI-TOF-MS se basan en secuencias objetivo o firmas moleculares específicas de los microorganismos de interés. Estas diferencias en la selectividad pueden causar desviaciones en los resultados notificados, especialmente cuando se comparan con métodos de cultivo que, en algunos casos, también se ha demostrado que crecen fuera de los organismos objetivo.
- El tiempo de respuesta puede variar mucho con los métodos basados en el cultivo y puede producir resultados en tan solo 24 horas o hasta diez días, dependiendo de los microorganismos de interés. Los métodos moleculares como la qPCR pueden proporcionar resultados el mismo día o al día siguiente, dependiendo de si el organismo de interés requerirá un enriquecimiento.
- Los métodos basados en el cultivo solo cultivarán células viables, mientras que la qPCR y la MALDI-TOF-MS no discriminen entre organismos vivos y muertos.
Consideraciones para las pruebas microbianas en cannabis.
La prueba microbiana en cannabis es compleja debido a muchas variables diferentes, algunas de las cuales son exclusivas de la planta. Una de estas propiedades únicas es la comunidad microbiana que reside de forma natural en la planta. Estos microbios endógenos se denominan endófitos y actúan como probióticos para la planta, ya sea evitando la colonización de microbios dañinos o ayudando en la producción de terpenos que sirven como mecanismo de defensa contra insectos y otros depredadores. Algunos de estos microbios crecerán en el cultivo y los cultivadores a menudo aplican estos microbios beneficiosos como pulverizadores foliares que pueden llevar a un recuento elevado al realizar pruebas de recuento total, aunque el uso del producto es perfectamente seguro.
También hay contaminantes microbianos en el cannabis que pueden eludir algunos métodos. Microorganismos que no se pueden cultivar, botrytis y mildiú polvoriento derivado del cannabis son algunos ejemplos de ello. Además de con microbios que no se pueden cultivar, el cannabis también puede estar contaminado con microorganismos como Ralstonia, que es un patógeno bacteriano que vive en el interior de las células fúngicas, muchas de las cuales son comunes al cannabis. También es una causa conocida de infecciones respiratorias en poblaciones inmunodeficientes [22-23]. Dado que estos microorganismos se encuentran dentro de los métodos de cultivo celular, estos no contendrán estos contaminantes.
Otro problema que se suma a estas complejidades es la falta de métodos estandarizados para las pruebas microbianas de la flor de cannabis y otros productos de cannabis. Además, muchos laboratorios están utilizando métodos de análisis microbianos que son para analizar productos alimenticios y no han sido validados en cannabis y otras matrices de productos de cannabis. Esta falta de métodos validados para el cannabis combinado con diferentes metodologías entre los laboratorios de análisis puede causar grandes desviaciones en los informes de un laboratorio a otro.
Direcciones futuras y conclusiones
Las pruebas microbianas para el cannabis son complejas debido a la amplia gama de metodologías utilizadas, las diversas matrices en las que se proporciona el cannabis y las comunidades microbianas únicas que se encuentran en la planta. Para abordar estos obstáculos, es importante que los laboratorios desarrollen y establezcan métodos de consenso para las pruebas microbianas. Independientemente de la metodología que se adopte, el laboratorio que emplee el método debe validarlo internamente en todas las matrices que se están probando para garantizar una detección y / o cuantificación óptimas de los contaminantes. Además, la presencia de endófitos cultivables y la práctica común de aplicación de microbios beneficiosos por parte de los cultivadores hacen que las pruebas de recuento total sean mucho menos efectivas para evaluar los riesgos microbianos. A la inversa, las pruebas específicas de patógenos pueden proporcionar información mucho más valiosa para la seguridad del usuario del cannabis, por lo que se debe hacer mayor hincapié en los riesgos conocidos para los consumidores.
Referencias
1. Mckernan K, Spangler J, Zhang L, et al. Cannabis microbiome sequencing reveals several mycotoxic fungi native to dispensary grade Cannabis flowers. F1000Res. 2015;4:1422.
2. Mckernan K, Spangler J, Helbert Y, et al. Metagenomic analysis of medicinal samples; pathogenic bacteria, toxigenic fungi, and beneficial microbes grow in culture-based yeast and mold tests. F1000Res. 2016;5:2471.
3. Sutton S, Lum BL, Torti FM. Possible risk of invasive pulmonary aspergillosis with marijuana use during chemotherapy for small cell lung cancer. Drug intelligence & clinical pharmacy. 1986 Apr;20(4):289-91.
4. Verweij PE, Kerremans JJ, Voss A, Meis JF. Fungal contamination of tobacco and marijuana. Jama. 2000 Dec 13;284(22):2875.
5. Ruchlemer R, Amit-Kohn M, Raveh D, Hanus L. Inhaled medicinal cannabis and the immunocompromised patient. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer. 2015 Mar;23(3):819-22.
6. Gargani Y, Bishop P, Denning DW. Too many mouldy joints - marijuana and chronic pulmonary aspergillosis. Mediterranean journal of hematology and infectious diseases. 2011;3(1):e2011005.
7. Bal A, Agarwal AN, Das A, Suri V, Varma SC. Chronic necrotising pulmonary aspergillosis in a marijuana addict: a new cause of amyloidosis. Pathology. 2010 Feb;42(2):197-200.
8. Szyper-Kravitz M, Lang R, Manor Y, Lahav M. Early invasive pulmonary aspergillosis in a leukemia patient linked to aspergillus contaminated marijuana smoking. Leukemia & lymphoma. 2001 Nov-Dec;42(6):1433-7.
9. Marks WH, Florence L, Lieberman J, Chapman P, Howard D, Roberts P, et al. Successfully treated invasive pulmonary aspergillosis associated with smoking marijuana in a renal transplant recipient. Transplantation. 1996 Jun 27;61(12):1771-4.
10. Llamas R, Hart DR, Schneider NS. Allergic bronchopulmonary aspergillosis associated with smoking moldy marihuana. Chest. 1978 Jun;73(6):871-2.
11. Hamadeh R, Ardehali A, Locksley RM, York MK. Fatal aspergillosis associated with smoking contaminated marijuana, in a marrow transplant recipient. Chest. 1988 Aug;94(2):432-3.
12. Chusid MJ, Gelfand JA, Nutter C, Fauci AS. Letter: Pulmonary aspergillosis, inhalation of contaminated marijuana smoke, chronic granulomatous disease. Annals of internal medicine. 1975 May;82(5):682-3.
13. Cescon DW, Page AV, Richardson S, Moore MJ, Boerner S, Gold WL. Invasive pulmonary aspergillosis associated with marijuana use in a man with colorectal cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2008 May 1;26(13):2214-5.
14. Remington TL, Fuller J, Chiu I. Chronic necrotizing pulmonary aspergillosis in a patient with diabetes and marijuana use. CMAJ : Canadian Medical Association journal = journal de l'Association medicale canadienne. 2015 Nov 17;187(17):1305-8.
15. Kagen SL. Aspergillus: an inhalable contaminant of marihuana. The New England journal of medicine. 1981 Feb 19;304(8):483-4.
16. Babu TM GM, Urban MA, et al. Aspergillosis Presenting as Multiple Pulmonary Nodules in an Immunocompetent Cannabis User. Journal of Toxicology and Pharmacology. 2017;1:004.
17. Taylor DN, Wachsmuth IK, Shangkuan YH, Schmidt EV, Barrett TJ, Schrader JS, et al. Salmonellosis associated with marijuana: a multistate outbreak traced by plasmid fingerprinting. The New England journal of medicine. 1982 May 27;306(21):1249-53.
18. Chagas GM, Oliveira MA, Campello AP, Kluppel ML. Mechanism of citrinin-induced dysfunction of mitochondria. IV--Effect on Ca2+ transport. Cell Biochem Funct. 1995;13(1):53-9.
19. Shirazi-zand Z, Ahmad-molaei L, Motamedi F, Naderi N. The role of potassium BK channels in anticonvulsant effect of cannabidiol in pentylenetetrazole and maximal electroshock models of seizure in mice. Epilepsy Behav. 2013;28(1):1-7.
20. Croxatto A, Prod'hom G, Greub G. Applications of MALDI-TOF mass spectrometry in clinical diagnostic microbiology. FEMS Microbiol Rev. 2012;36(2):380-407.
21. Pham VH, Kim J. Cultivation of unculturable soil bacteria. Trends Biotechnol. 2012;30(9):475-84.
22. Spraker JE, Sanchez LM, Lowe TM, Dorrestein PC, Keller NP. Ralstonia solanacearum lipopeptide induces chlamydospore development in fungi and facilitates bacterial entry into fungal tissues. The ISME journal. 2016 Sep;10(9):2317-30.
23. Spraker JE, Jewell K, Roze LV, Scherf J, Ndagano D, Beaudry R, et al. A volatile relationship: profiling an inter-kingdom dialogue between two plant pathogens, Ralstonia Solanacearum and Aspergillus Flavus. Journal of chemical ecology. 2014 May;40(5):502-13.
24. Lucarelli C, Di Domenico EG, Toma L, Bracco D, Prignano G, Fortunati M, et al. Ralstonia mannitolilytica infections in an oncologic day ward: description of a cluster among high-risk patients. Antimicrobial resistance and infection control. 2017;6:20. PubMed PMID: 28191308.
25. Waugh JB, Granger WM, Gaggar A. Incidence, relevance and response for Ralsfonia respiratory infections. Clinical laboratory science : journal of the American Society for Medical Technology. 2010 Spring;23(2):99-106. PubMed PMID: 20499534. Pubmed Central PMCID: 4086841.
26. Coenye T, Vandamme P, LiPuma JJ. Infection by Ralstonia species in cystic fibrosis patients: identification of R. pickettii and R. mannitolilytica by polymerase chain reaction. Emerging infectious diseases. 2002 Jul;8(7):692-6.
27. Ryan D, Drysdale AJ, Lafourcade C, Pertwee RG, Platt B. Cannabidiol targets mitochondria to regulate intracellular Ca2+ levels. J Neurosci. 2009;29(7):2053-63.
28. Scott M, Rani M, Samsatly J, Charron JB, Jabaji S. Endophytes of industrial hemp (Cannabis sativa L.) cultivars: identification of culturable bacteria and fungi in leaves, petioles, and seeds. Can J Microbiol. 2018;:1-17.