Por Tanja Bagar

La Dra. Tanja Bagar es microbióloga con un doctorado en Biomedicina. Ha adquirido una amplia experiencia en investigación en biotecnología, biología molecular y señalización celular en laboratorios en Eslovenia, Alemania y Reino Unido. Su enfoque se ha centrado principalmente en el sistema endocannabinoide y las sustancias activas de cannabis/cáñamo. Su trabajo condujo a la formación del Instituto Internacional de Cannabinoides (ICANNA), donde es CEO y presidenta del Consejo de Expertos. También es directora adjunta y responsable de I+D en una empresa ambiental. También está activa en el ámbito académico. Es profesora de microbiología y decana del programa de maestría de Ecoremediaciones de la Facultad Alma Mater Europaea.
La autofagia es un proceso evolutivo de autolimpieza que tiene lugar en las células. La palabra autofagia significa, literalmente, comerse a sí mismo, y viene de las palabras griegas auto, que significa uno mismo y phagein que significa comer. El término fue acuñado por el premio Nobel Christian de Duve, un investigador celular belga que recibió el reconocimiento en 1974 junto a sus dos colegas por su descubrimiento sobre la organización estructural y funcional de las células.
En 2016, el premio Nobel fue otorgado al investigador japonés Yoshinori Ohsumi, que estudió con detalle el proceso de la autofagia. Durante el proceso de autofagia, los componentes celulares dañados, las proteínas no utilizadas y otros residuos celulares, son incorporados a una vesícula denominada autofagosoma, de manera similar a como acumulamos los residuos domésticos en bolsas de basura. En humanos, las vesículas son transportadas a lisosomas, unos orgánulos celulares. Estos orgánulos tienen una función similar a la que tienen las plantas de reciclaje, pues descomponen y reciclan los materiales que se encuentran en el interior de los autofagosomas para poder reutilizarlos después. En las células humanas, la autofagia implica la formación de un elemento de doble membrana con forma cóncava denominado fagóforo, que envuelve y encierra el material que ha de ser degradado formando un autofagosoma esférico de doble membrana. Finalmente, la membrana externa del autofagosoma se fusiona con un lisosoma para forma un autolisosoma, que resulta en la degradación de la membrana interna del autofagosoma y de los materiales en su interior.
¿Cómo tiene lugar la autofagia?
El concepto básico de autofagia se conoce gracias al trabajo de varios científicos pioneros que observaron el proceso cuando las células no tenían nutrientes, estaban hambrientas. Pero con los estudios de más científicos, se hizo evidente que este "sencillo" reciclado era, en realidad, un complejo proceso celular. A pesar de que ha sido estudiado mayoritariamente en células de levadura, se sabe que el proceso es muy similar en células humanas.
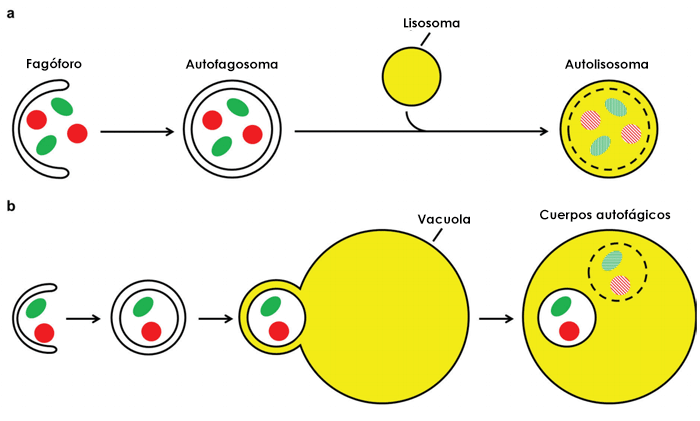
Figura 1: Vía de la autofagia en células humanas (a) y levaduras (b). Fuente: Frake, Becca & Rubinsztein, David. (2016). Yoshinori Ohsumi’s Nobel Prize for mechanisms of autophagy: From basic yeast biology to therapeutic potential. Journal of the Royal College of Physicians of Edinburgh. 46. 228-233. 10.4997/JRCPE.2016.403.
(a) En las células humanas, el fagóforo se cierra envolviendo el material citoplasmático formando un autofagosoma esférico de doble membrana. La membrana externa del autofagosoma se fusiona con un lisosoma para formar un autolisosoma, lo que resulta en la degradación de la membrana interna del autofagosoma y del material del interior.
(b) La vía es similar en levaduras, excepto que la membrana externa del autofagosoma se fusiona con una vacuola. Esta fusión forma cuerpos autofágicos de una sola membrana dentro de la vacuola que son degradados junto con la carga retenida.
La autofagia es un mecanismo para mantener la homeostasis celular. Su función es una especie de "mantenimiento del hogar" en procesos fisiológicos normales, reutilizando materiales y energía de las células. A pesar de ser un proceso vital, está rigurosamente regulado. Se descubrió que las células con falta de nutrientes, es decir, las que están hambrientas, inician la autofagia. Parece que es especialmente la falta de aminoácidos, los elementos que forman las proteínas, lo que inicia el proceso de autofagia. Este descubrimiento fue uno de los motivos principales por los que el ayuno intermitente y los ciclos de proteínas se han hecho tan famosos. El primero provoca una deficiencia de nutrientes cuando nos saltamos alguna comida y ayunamos entre 12 y 16 horas, con lo que se inicia la autofagia. El segundo implica limitar la ingesta de proteínas ciertos días para reproducir una falta de aminoácidos, favorecer la autofagia y renovar las células y nuestro cuerpo. También se ha demostrado que el ejercicio activa los genes que inician la autofagia, lo que destaca aún más el papel que juega un estilo de vida saludable.
La primera sustancia que se descubrió que inducía la autofagia fue la rapamicina. Inicialmente, la rapamicina fue etiquetada como un inmunosupresor y se utilizaba para tratar a los pacientes con trasplante renal. Investigaciones posteriores demostraron que tiene muchos efectos: reduce el riesgo de infección por CMV en pacientes con trasplantes de órganos, mejora la inmunidad frente al cáncer y los patógenos en ratones, prolonga la vida en ratones propensos a las infecciones y protege a los ratones viejos de padecer neumonía, efectos principalmente mediados por la vía autofágica. También hay componentes naturales, de los que hablaremos más adelante en este artículo, que pueden inducir la autofagia.
El papel de la autofagia en la salud y en la enfermedad
La autofagia es vital para la salud, pero puede jugar un papel tanto citoprotector como citopático dependiendo de las diferentes señales y factores estresantes a los que las células estén expuestos. Los investigadores y los médicos tienen la esperanza de que, manipulando la actividad de la autofagia, seremos capaces de modificar los procesos de ciertas enfermedades, por lo que la autofagia se está convirtiendo en un objetivo farmacológico importante. Sus efectos son muy variados en muchas condiciones, pero en este artículo hablaremos brevemente de sus efectos sobre las infecciones y la inmunidad.
Las infecciones por patógenos generan una activación del sistema inmune del huésped, y la autofagia es parte de la respuesta para su eliminación. Para que se dé una respuesta inmune favorable, es necesario matar y eliminar a las bacterias y los virus intracelulares. Si la autofagia es la degradación de sí mismo, cuando se trata de la degradación de patógenos se denomina xenofagia (degradación de un cuerpo extraño). Parece que esta es la forma más ancestral de defensa frente a los agentes patógenos. La autofagia se activa en la mayor parte de las infecciones bacterianas. Se ha observado que un grupo muy común y potente de bacterias causantes de enfermedades como los estreptococos del grupo A, Salmonella typhimurium y Mycobacterium tuberculosis son degradadas y eliminadas mediante la autofagia, como se muestra en la figura 4. Lo mismo se observó para muchas otras bacterias patógenas. Los efectos de algunos fármacos también se basan en la regulación de la autofagia, por ejemplo, los efectos antimicobacterianos de la calcimicina, utilizada para las infecciones de Mycobacterium bovis. También se ha observado que algunas bacterias evitan la degradación por autofagia. En las infecciones virales, la autofagia puede jugar tanto un papel antiviral como proviral. Por un lado, las proteínas relacionadas con la autofagia se dirigen a partes virales para su degradación, pero también participan en el inicio de las respuestas inmunes innatas y adaptativas a las infecciones virales. De forma similar a las bacterias, algunos virus también son capaces de interaccionar con los mecanismos de la autofagia y bloquearlos. Algunos virus pueden, además, utilizar componentes de estos mecanismos para su propio crecimiento y replicación.
Pero no solo la eliminación de patógenos está regulada por la autofagia, sino también muchos otros aspectos de la inmunidad adaptativa e innata, como la presentación de antígenos o la producción de citoquinas e interferones, regulando la inflamación y el desarrollo de linfocitos.
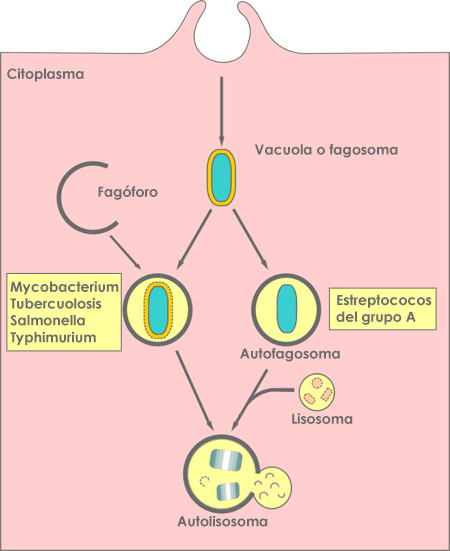
Figura 4: Diagrama de las maneras en las que la autofagia tiene como objetivo bacterias intracelulares. Fuente: Huang J, Brumell JH. Bacteria-autophagy interplay: a battle for survival. Nat Rev Microbiol. 2014;12(2):101-114. doi:10.1038/nrmicro3160.
Se sabe que defectos en la regulación de la autofagia son factores importantes en una gran cantidad de enfermedades, como las enfermedades neurodegenerativas, el cáncer y enfermedades metabólicas. Cabe esperar que, con un conocimiento profundo de la autofagia, sabiendo cómo activarla y desactivarla en el momento correcto, podremos influenciar el inicio y la progresión de un amplio rango de enfermedades.
La autofagia y los cannabinoides
Conociendo la importancia de la autofagia, surge la pregunta del efecto de los cannabinoides sobre la misma. Se sabe que varias plantas y sus componentes inducen la autofagia, como los cítricos, la bergamota, el té verde, la canela o el resveratrol. Estudios de investigación sobre el papel de los cannabinoides en la autofagia han demostrado que los cannabinoides inducen la autofagia en células sanas y tumorales. Inducir la autofagia puede ser bueno o malo dependiendo del estado de la célula. Si bien la autofagia a nivel basal es necesaria para la supervivencia de células y organismos, la activación prolongada de la autofagia o su inducción en un momento equivocado pueden tener efectos adversos.
Incluso en las primeras fases de la vida, la relación entre el sistema endocannabinoide y la autofagia es muy importante. Inmediatamente después de la fertilización, durante el desarrollo embrionario, la autofagia se activa intensamente en los ovocitos fertilizados, incluso antes de la implantación. Se supone que la autofagia es necesaria durante el desarrollo embrionario temprano para la degradación de las proteínas maternas y el RNAm que ya no es necesario. Se sabe que, durante los primeros días del embarazo, la autofagia se mantiene la mayor parte del tiempo a nivel basal en los blastocitos, pero en ratones se reduce drásticamente el cuarto día, cuando el momento de la implantación está más cerca. En ese momento, los niveles de anandamida del útero están drásticamente reducidos, lo que muestra una correlación evidente entre la concentración de anandamida y la autofagia en blastocitos.
Esto demuestra que los endocannabinoides son potenciales reguladores de la autofagia. Dado que la producción de las cantidades adecuadas de anandamida y la inducción de la autofagia son fundamentales para el desarrollo embrionario y la implantación en ratones, los aumentos de los niveles de anandamida en un momento no adecuado pueden provocar la activación de la autofagia en embriones en momentos inoportunos, causando la muerte celular en los embriones de los ratones. Lo mismo se ha observado al añadir un agonista selectivo del CB1R (la metanandamida, MET), que también activa la autofagia. Se sabe que 7 nM de MET es la dosis fisiológica adecuada para embriones, mientras que una dosis de 28 nM produce efectos adversos en el embarazo de ratones y ovejas. Si se inyecta MET el cuarto día, cuando la anandamida y la autofagia están a niveles bajos, o si se expone a los ratones a elevadas cantidades de MET en los primeros días de embarazo, la autofagia se activa y no tiene lugar la implantación con la subsecuente pérdida de embriones.
Esto pone de manifiesto la importancia de que la autofagia suceda en el momento adecuado. Dado que tanto la autofagia como el sistema endocannabinoide tienen como fin mantener la homeostasis de las células y el cuerpo, su relación no es de extrañar. Los endocannabinoides se producen a nivel local bajo demanda en respuesta a señales del entorno, lo que hace que sean inductores perfectos y rápidos de la autofagia.
Los fitocannabinoides también pueden inducir la autofagia. Ya en 2009 se demostró que el THC provoca la muerte celular, sobre todo mediante la autofagia, de células de gliomas, en los xenoinjertos de tumores y en las muestras tumorales humanas, pero no en las células neuronales normales. Las células madre de un glioma representan una subpoblación de células tumorales resistentes a la quimioterapia. El CBD desencadena los procesos autofágicos en estas células e inhibe su proliferación y su capacidad clonogénica. Sobre todo, el CBD combinado con la carmustina, un medicamento quimioterapéutico, inducen la muerte celular y reducen el crecimiento del tumor.
En las células del cáncer de mama, el CBD aumenta la autofagia, mientras que la Beclin-1 es fundamental en la inducción. El efecto del CBD es independiente del receptor, principalmente a través del estrés oxidativo y sus efectos sobre las mitocondrias. Un cannabinoide sintético, el O-1663 (agonista del CBR2), también ha demostrado inducir la autofagia y la apoptosis en las células del cáncer de mama, especialmente en las células cancerígenas metastásicas. Por tanto, el CBG, un fitocannabinoide con afinidad por el CBR2 tiene un papel importante en el tratamiento del cáncer de mama.
También se ha observado que el CBD induce la autofagia de manera dependiente a la dosis en células Caco-2 totalmente diferenciadas, un modelo de células del epitelio intestinal maduro. En este modelo, el ACEA, un agonista del CBR1 y la anandamida también inducen de manera independiente la autofagia mediante un receptor tipo 1 de los cannabinoides y un receptor del CDB. Este podría ser uno de los mecanismos que explican las aplicaciones terapéuticas de los cannabinoides en enfermedades inflamatorias intestinales. En un modelo de trastornos neurodegenerativos complejos en ratón, se ha demostrado que una combinación a partes iguales de THC y CBD (nombre comercial Sativex®), reduce la deposición amiloide y de la proteína tau en el hipocampo y la corteza cerebral a través de distintos mecanismos incluyendo la estimulación de la autofagia, poniendo de manifiesto los mecanismos tras las propiedades neuroprotectoras de los cannabinoides.
Conclusión
En células sanas, la inducción de la autofagia contribuye a un mejor funcionamiento de los órganos y a una ralentización del envejecimiento. Se ha demostrado que el CBD protege las células hepáticas de ratones de la esteatosis aguda inducida por el alcohol a través de múltiples mecanismos como la activación o el aumento de la autofagia. Con respecto al cáncer, se ha demostrado que la manera en la que los cannabinoides interaccionan con las células tumorales depende del tipo de tumor, del cannabinoide en concreto y de los receptores específicos de cannabinoides, pero en última instancia se produce la autofagia. Sin embargo, aún no se conocen plenamente las consecuencias de la activación de la autofagia en todas las patologías. En algunos casos, la autofagia actúa como un mecanismo de muerte o puede actuar como mecanismo citoprotector, dependiendo del contexto celular y de la intensidad y duración del estímulo de inicio. Quedan muchos aspectos por descubrir y esperamos que en un futuro cercano tengamos más respuestas sobre cuándo y cómo debemos utilizar los cannabinoides para la autofagia en distintas enfermedades. No obstante, no hay duda alguna de que los cannabinoides promueven la activación de la autofagia y el mejor mantenimiento del equilibrio bioquímico en células, órganos, tejidos y en todo el cuerpo y el cerebro en general.